
UNIVERSITA’ DEGLI STUDI DI SIENA
FACOLTA’ DI MEDICINA E CHIRURGIA
Scuola di Specializzazione in Igiene e Medicina Preventiva
Prevenzione dell’infezione crociata in Odontoiatria: recenti acquisizioni della ricerca scientifica e tecnologica
Relatore:
Chiar.ma Prof.ssa Teresa Pozzi
Tesi di Specializzazione di:
Dr. Mario del Prato
Anno Accademico 2003 – 2004
INDICE
INTRODUZIONE ………………………………………….........................................................…………..……… pag. 1
1. LE INFEZIONI CROCIATE ………………........................................................……………………..….…... pag. 4
2. RISCHIO INFETTIVO IN ODONTOIATRIA ……….........................................................…………..…...... pag. 8
2.1. Rischio di infezione da HBV ………………………………........................................................…..…… pag. 9
2.2. Rischio di infezione da HCV ……………........................................................…………………..……… pag. 11
2.3. Rischio di infezione da HIV …………………........................................................……………..……… pag. 13
3. LE MODALITA’ DI CONTAMINAZIONE DELLA STRUMENTAZIONE ODONTOIATRICA .…........ pag. 15
3.1. Contaminazione da parte di microrganismi provenienti dal paziente in corso di trattamento ............... pag. 16
3.2. Contaminazione da parte di microrganismi provenienti dall’acqua di alimentazione ............................. pag. 24
3.3. Contaminazione da parte di microrganismi provenienti dai condotti interni del riunito: il biofilm ........ pag. 26
3.4. Airborne infection ...................................................................................................................................... pag. 34
3.5. Contaminazione della linea pneumatica e dei dispositivi aspiranti ........................................................ pag. 36
4. La prevenzione delle infezioni crociate ..…............................................................……...… pag. 38
4.1. Riduzione della contaminazione del riunito ………………….................................................................. pag. 38
4.2. Identificazione precoce del paziente infetto …………………................................................................. pag. 52
4.3. Gestione dello strumentario ………………………….......................................................………....….. pag. 55
4.4. Ciclo di trattamento degli strumenti nell’ambulatorio odontoiatrico …....…………………………...... pag. 58
4.5. Utilizzo di materiale monouso ……………………….......................................................………….…... pag. 62
4.6. Procedure antimicrobiche e Sterilizzazione ……….......................................................……………....... pag. 62
4.7. Disinfezione dei materiali da impronta ……………………….........................................................….... pag. 71
4.8. Protezione di operatori e Precauzioni universali ……………..…............................................................ pag. 74
4.9. Protezione e ruolo del personale ausiliario ...….……......................................................…………....... pag. 77
4.10. Gestione del paziente ………………..........................................................…………………………….... pag. 78
4.11. Altre misure di prevenzione ………………………………..........................................................……...... pag. 79
4.12. Controllo microbiologico ambientale in ambulatorio odontoiatrico …………………………...….......… pag. 80
4.13. Protocolli di gestione del riunito ………………………..........................................................…………... pag. 84
5. ASPETTI LEGISLATIVI ………………………………………….........................................................…..… pag. 86
5.1. Le norme armonizzate: aspetti generali …………….......................................................…………….... pag. 86
5.2. Norme armonizzate di riferimento per la sterilizzazione a vapore ………………………………….…. pag. 87
5.3. Caratteristiche di un autoclave a vapore, convalida e controlli ...…………………………………....... pag. 90
5.4. Immunoprofilassi dell’ epatite B …………….......................................................………………..….… pag. 95
5.5. Smaltimento dei rifiuti ………………………………………........................................................…..…. pag. 98
5.6. Il controllo della applicazione delle misure preventive ………...…........................................................ pag. 98
5.7. L’accreditamento …………………………………………….......................................................….….. pag. 99
BIBLIOGRAFIA ………………………………….........................................................……………………...….. pag. 101
Le grandi scuole di igiene si sono recentemente confrontate su un tema di interesse comune: la protezione dall'infezione nell'attività sanitaria ed in particolare in quella odontoiatrica.
Anche sotto un profilo applicativo è risultata sempre più indispensabile la comprensione approfondita dei fenomeni connessi al rischio infettivo e delle possibili prospettive di controllo sul territorio.
Siamo, in effetti, in presenza di un rischio infettivo, valutato, misurato e ripetutamente confermato dalla ricerca italiana e internazionale: sottoporsi alle cure del dentista significa anche correre il rischio di essere infettati dalle sue attrezzature, malgrado l'applicazione delle cosiddette "precauzioni universali".
Già nel dicembre 1995 Prevost et al. sul N. Y. State Dent. J. pubblicavano un lavoro dal titolo emblematico: Doctor would you drink water from your dental unit? (Prevost, 1995).
Numerose ricerche internazionali, anche sostenute dal Ministero dell'Istruzione, dell'Università e della Ricerca (MIUR), da varie Università e dai principali produttori italiani di riuniti dentali, hanno infatti dimostrato che l'acqua erogata sul campo operatorio con gli spray degli strumenti odontoiatrici (turbine, micromotori, siringa aria/acqua) possiede un'ampia potenzialità infettiva.
Il fenomeno deriva, tra l'altro, dalla penetrazione di microrganismi umani (batteri e virus) provenienti dal paziente all'interno dei circuiti idrici del riunito, evento che può trasmettere l'infezione a successivi pazienti durante la cura odontoiatrica: si è infatti dimostrata anche la concreta possibilità di trasmettere, tramite gli spray del riunito dentale, infezioni particolarmente gravi, di tipo virale, quali ad esempio l'Epatite C.
Sappiamo come sia estremamente difficile poter collegare la manifestazione di una patologia infettiva ad un evento di infezione causato ad esempio dalla cura dentale a causa del periodo "finestra" che può intercorrere fra il contagio e lo sviluppo della patologia.
Dolci G., nel simposio di sintesi del Congresso Nazionale del Collegio dei Docenti di Odontoiatria tenutosi a Roma nel 2003, riferisce che si vanno affermando le consuetudini di non far donare il sangue o il cordone ombelicale a soggetti che hanno subito cure odontoiatriche nei sei mesi precedenti suggerendo che l’avvento delle cosiddette “patologie emergenti” ha indotto una maggiore attenzione negli operatori sanitari e una sempre più elevata sensibilizzazione da parte della popolazione in generale (Dolci , 2003).
Lo strumento principale a disposizione degli operatori sanitari per contenere questo rischio è sicuramente la prevenzione in tutti i suoi principali aspetti (la limitata contaminazione delle superfici, l’uso di barriere protettive, la disinfezione e la sterilizzazione, la vaccinazione del personale, ecc.), ma è anche di fondamentale importanza che da parte degli operatori sanitari odontoiatrici vi sia una adeguata conoscenza e un continuo aggiornamento sull’epidemiologia delle malattie infettive (Pozzi , 2001).
In realtà vi è oggi ampia e documentata riprova scientifica che il problema infettivologico va al di là del ferro chirurgico o dello strumento collegato al riunito odontoiatrico per estendersi ad un ambito assolutamente incontrollabile da parte dell'odontoiatra, al di là di quanto le procedure attualmente previste possano tutelare: oggi è dimostrato che anche uno strumento sterilizzato, quindi sterile, può ancora erogare un liquido infetto, perché proveniente dal circuito del riunito già infettato dal paziente precedente; nessun trattamento di sterilizzazione del solo strumento può quindi proteggere da questo tipo di rischio.
La produzione di spray contaminati determina effetti anche sulla qualità igienica dell'aria che si respira nell'ambiente odontoiatrico. Nuove ricerche hanno infatti confermato un notevole incremento della carica aerodispersa durante la terapia dentale, fino a rilevare livelli di contaminazione davvero inaccettabili per un ambiente sanitario.
Questo aspetto è ancora scarsamente avvertito dall'odontoiatra, che è abituato a considerare il rischio infettivo come circoscritto al solo strumento, mentre sfugge alla sua attenzione l'acqua erogata dal riunito con gli spray degli strumenti.
Il problema inoltre non riguarda solo l’odontoiatra in prima persona ma anche il personale ausiliario che collabora nello studio: addetti alle poltrone, assistenti igienisti, odontotecnici.
Per questo motivo è necessario che le norme di disinfezione e prevenzione siano dettate in modo chiaro, a conoscenza di tutto il personale e rispettate da tutti e che in campo odontoiatrico, come è gia accaduto in altri settori quali ad esempio quello alimentare, si inizi a definire una normativa per la prevenzione dell'infezione crociata, con strumenti attuativi efficaci, applicabili, e facilmente controllabili.
È necessaria inoltre la realizzazione di protocolli di lavoro che stabiliscano i modi ed i tempi per ottenere gli scopi prefissati (Maggiore, 1996).
Quando la trasmissione dell'infezione avviene nel contesto o a causa di un intervento medico sanitario, si parla di trasmissione "iatrogena", cioè provocata dalla cura medica. Anche l'odontoiatria può essere occasione di trasmissione iatrogena di infezione, secondo vie di trasmissione che dipendono dalle persone coinvolte e dalle attrezzature utilizzate (figura 1).
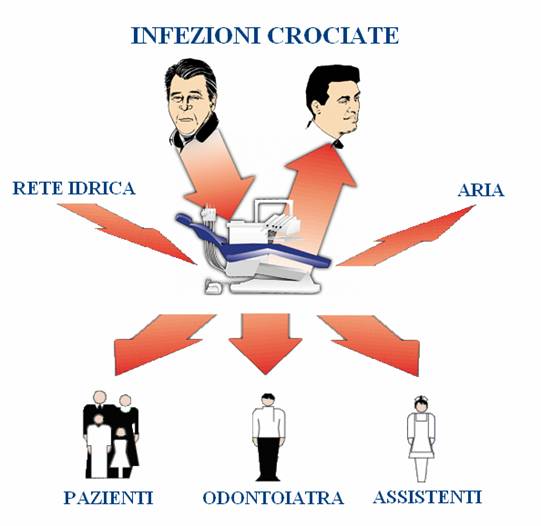
Figura 1: Vie delle infezioni crociate.
Le vie di trasmissione dei microrganismi in odontostomatologia ricalcano quelle classiche, ossia diretta, semidiretta e indiretta.
La trasmissione diretta è la più rilevante perché quasi sempre si hanno lesioni spontanee o iatrogene dei tessuti della bocca con conseguente fuoriuscita di sangue.
La trasmissione semidiretta consente a breve distanza la propagazione di microrganismi veicolati da aerosol mosso da moti convettivi presenti nell’ambiente interessato (es.: gli strumenti rotanti con raffreddamento ad acqua sono in grado di nebulizzare un gran numero di microrganismi).
La trasmissione indiretta è dovuta alla presenza di microrganismi su oggetti, strumenti e superfici di lavoro (Pozzi, 2001).
Le modalità di trasmissione più frequenti possono essere distinte per il personale odontoiatrico, di assistenza e per i pazienti. Per il personale sono soprattutto il contatto diretto con aerosol e goccioline di sangue e saliva, il contatto diretto di piccole soluzioni di continuità della cute con sangue e saliva, la puntura accidentale con strumenti taglienti. Per i pazienti è invece più frequente il contatto diretto delle mucose orali con le mani contaminate dell’operatore e l’utilizzo di attrezzature sanitarie infette.
In tempi recenti e in molte branche della medicina la diffusione di patologie infettive è stata significativamente arginata, grazie all'uso di tecniche stringenti di sterilizzazione e all'introduzione sempre più diffusa di materiale sterile monouso. Tuttavia la crescente diffusione di strumenti complessi, progettati con tecnologie avanzate e costruiti con materiali sofisticati, introduce un fattore di oggettiva difficoltà, sia per l'impossibilità di disporre di strumenti monouso, sia per le difficoltà di sterilizzazione degli strumenti riutilizzabili. Si pensi ad esempio a strumenti che non possono essere trattati con il calore o con reagenti aggressivi (sonde per cateterismo cardiaco ed angioplastica, sonde per endoscopia, strumentario odontoiatrico, etc.): in casi del genere la progettazione di strumenti monouso è impensabile e la loro complessità tecnologica ne impedisce di fatto la sterilizzazione in autoclave (Lewis, 1992, b).
In campo odontoiatrico, come per ogni altra branca medica, le fonti o sorgenti di infezione sono rappresentate principalmente dal paziente, che può presentare i segni clinici di alcune patologie contagiose o può essere semplice portatore di agenti infettivi.
Il portatore può essere un individuo convalescente, identificato grazie ad una corretta anamnesi, o un soggetto asintomatico che non sa di essere affetto da patologia infettiva ma ne alberga e ne può diffondere i microrganismi responsabili. Ne sono un esempio gli affetti da epatiti B e C i quali, anche se non manifestano sintomi specifici ed hanno un decorso in forma clinicamente latente, sono però portatori dei rispettivi virus, che possono essere presenti sia nella secrezione salivare sia a livello ematico e possono perciò essere trasmessi ad altri soggetti. Tra le infezioni potenzialmente trasmesse per via iatrogena ve ne sono alcune caratterizzate da un'alta morbosità come HIV, HBV, HCV o la Tubercolosi (tabella 1).
Il rischio di trasmissione di infezioni è in larga misura connesso anche alla natura del riunito odontoiatrico, complessa apparecchiatura elettromedicale comprendente la poltrona per il paziente, l'insieme della strumentazione caudata (ovvero quella collegata al riunito stesso tramite cordoni di alimentazione) e i relativi circuiti elettrici, idrici e pneumatici, i dispositivi di aspirazione, la lampada di illuminazione del campo operatorio, i servizi idrici per il paziente (bicchiere e bacinella) e, talvolta, mezzi di supporto diagnostico quali dispositivi di ripresa endorale.
Non meno importante è il compartimento delle acque provenienti dalla rete idrica di approvvigionamento potabile.
Le principali fonti di contaminazione sono dunque rappresentate dalla rete idrica e dal paziente, mentre una complessa architettura elettromedicale come il riunito, gli operatori in sala odontoiatrica, l’aerosol normalmente diffuso nella sala stessa ed il resto della strumentazione fungono da interfaccia di una possibile diffusione delle cross-infection.
Malattia |
Agente |
Via di trasmissione |
Periodo di incubazione |
Complicazioni potenziali |
|
AIDS |
Virale |
Sospettato il contatto diretto (sangue) |
12 mesi o più |
Morte |
|
Congiuntivite erpetica |
Virale |
Saliva, sangue, goccioline |
6-10 settim. |
Cecità potenziale |
|
Epatite A |
Virale |
Orale, fecale |
2-7 settim. |
Infermità |
|
Epatite B |
Virale |
Saliva, sangue, goccioline |
6 settim. 5 mesi |
Infermità cronica portatore, morte |
|
Epatite non A non B |
Virale |
Saliva, sangue, goccioline |
6 settim. 5 mesi |
Infermità cronica, morte |
|
Batterico |
Contatto sessuale |
1-7 giorni |
Artrite, sterilità femminile,cecità infantile |
|
|
Virale |
Contatto sessuale, possibile saliva, sangue |
Fino a 2 settim. |
Lesioni dolorose, morte bambini |
|
|
Infezioni da Stafilococco |
Batterico |
Saliva, sangue, goccioline |
4-10 giorni |
Lesioni cutanee, morte |
|
Infezioni da Streptococco |
Batterico |
Saliva, sangue, goccioline |
1-3 giorni |
Cardiache, epatiche, morte |
|
Influenza |
Virale |
Saliva, goccioline |
1-3 giorni |
Morte |
|
Legionellosi |
Batterico |
Respiratoria |
2-10 giorni |
Morte |
|
Mononucleosi infettiva |
Virale |
Saliva, sangue, goccioline |
4-7 settim. |
Infermità temporanea |
|
Morbillo |
Virale |
Saliva, sangue, goccioline |
9-11 giorni |
Infermità temporanea, encefalite |
|
Parotite epidemica |
Virale |
Respiratoria |
14-25 giorni |
Infermità temporanea, sterilità |
|
Patereccio erpetico |
Virale |
Saliva, sangue, goccioline |
2-12 giorni |
Forte dolore, infermità |
|
Polmonite |
Batterico, virale |
Respiratoria, sangue |
Varia nei soggetti |
Morte |
|
Raffreddore comune |
Virale |
Saliva, sangue, goccioline |
48-72 ore |
Infermità temporanea |
|
Rosolia |
Virale |
Saliva, sangue, goccioline |
9-11 giorni |
Difetti congeniti, morte infantile |
|
Sifilide |
Batterico |
Contatto sessuale, congenita |
2-12 giorni |
Neurologiche, morte |
|
Tetano |
Batterico |
Ferita aperta |
7-10 giorni |
Infermità, morte |
|
Tubercolosi |
Batterico |
Saliva, goccioline |
Fino a 6 mesi |
Infermità, morte |
|
Varicella |
Virale |
Saliva, sangue, goccioline |
10-21 giorni |
Congiuntivite, fuoco di S. Antonio, encefalite |
Tabella 1: Importanti malattie infettive che possono essere trasmesse in ambiente odontoiatrico. Da Runnels R.R.: Controllo dell’infezione negli Studi Odontoiatrici. I.T.E. edit., Dolo (Ve), 1985.
2. RISCHIO INFETTIVO IN ODONTOIATRIA
I pazienti e gli operatori odontoiatrici sono correntemente esposti ad agenti morbigeni trasmessi attraverso il sangue o attraverso secrezioni orali o respiratorie. Questi microrganismi possono includere Cytomegalovirus, HBV, HCV, Herpes simplex virus tipo 1 e 2, HIV, Mycobacterium tuberculosis, Stafilococchi, Streptococchi ed altri, specie quelli responsabili di infezioni del tratto respiratorio superiore (CDC, 1993) (figura 2).

Figura 2: I più comuni microrganismi coinvolti nelle cross-infezioni.
I microrganismi trasmissibili durante le manovre odontoiatriche sono teoricamente tutti quelli che infettano l'operatore e/o il paziente e che sono presenti nei tessuti e nei liquidi biologici con cui si viene a contatto nell' esecuzione delle pratiche odontoiatriche (Scotti, 1992).
Tuttavia quelli trasmessi attraverso il sangue, in particolare i virus delle epatiti B e C (HBV e HCV) e l'infezione da HIV rivestono sicuramente maggiore importanza per la gravità e per interesse in Sanità Pubblica; inoltre assumono particolare importanza in questo ambito dato il facile sanguinamento provocato dalle cure dentali.
Il personale sanitario odontoiatrico ha un rischio di esposizione alle infezioni 6-8 volte maggiore rispetto alla popolazione generale (Sagliocca, 1993).
2.1 Rischio di infezione da HBV
Il rischio di contrarre l’epatite negli operatori sanitari è stato oggetto di numerosi studi. Negli Stati Uniti indagini sierologiche hanno evidenziato che il 10-30% degli operatori sanitari (compresi gli odontoiatri) è stato esposto all’ HBV (CDC, 1993).
Il rischio di infezione da HBV negli operatori odontoiatrici è stato stimato essere da 3 a 6 volte superiore rispetto a quello della popolazione generale: negli Stati Uniti il 15% dei dentisti ed il 25% dei chirurghi orali risulta essere anti-HBs positivo e l’11% portatore cronico del virus (Francetti, 1993).
In uno studio condotto a Siena su odontoiatri e personale di assistenza è emerso che nessuno era HbsAg positivo, circa la metà dei soggetti non vaccinati per l’epatite B era positivo per almeno un marcatore dell’HBV (anti-HBs e/o anti-HBc) (Gasparini, 1999).
In America è stato calcolato che la probabilità del personale di assistenza di contrarre l’infezione dell’epatite B durante la loro carriera è del 25% contro il 3-5% della popolazione (U.S. D.H.H.S., 1986).
Il fattore di rischio più importante è rappresentato dalla ferita o puntura accidentale con materiale infetto.
Il rischio di contrarre un’infezione dopo puntura accidentale con ago contaminato va da 6 al 30% (U.S. D.H.H.S., 1989).
Il rischio infettivo dopo puntura accidentale con sangue infetto è stato calcolato pari al 10-35% per HBV, al 4-6% per HCV e soltanto allo 0,5-1% per HIV (CDC, 1991).
Così il rischio per l’infezione da HBV risulterebbe 20-50 volte superiore a quello per l’ HIV.
Da studi eseguiti con indagini sierologiche e questionari è emerso che l’80% dei soggetti con markers di infezione da HBV che si presenta in ambulatorio odontoiatrico non sa di avere contratto l’epatite.
Ciò porta a considerare ogni paziente che giunge in ambulatorio come potenzialmente a rischio, 4 volte su 5 non sa di aver avuto un’epatite B (U.S. D.H.H.S., 1986).
L’odontoiatra ed il paziente possono contagiarsi reciprocamente in modo relativamente semplice, dato che nel corso del trattamento vengono nebulizzati sangue e saliva.
I pazienti portatori sani del virus rappresentano il maggior pericolo per la trasmissione dell’HBV.
L’odontoiatra si può infettare da pazienti portatori di HBV soprattutto per ferite da ago.
Secondariamente il contagio può avvenire attraverso il sangue e la saliva del paziente che giungono negli occhi o sulla mucosa nasale ed orale dell’odontoiatra o dei suoi collaboratori durante il trattamento odontoiatrico.
Infine l’infezione può essere veicolata anche da denti estratti, strumenti, e superfici, che sono stati contaminati con sangue o con residui di saliva.
Dato che il virus HBV, durante il trattamento odontoiatrico, viene spesso nebulizzato dagli aerosol, non si devono considerare contaminati solo gli strumenti e le superfici sulle quali sono stati posati gli strumenti, ma anche le superfici sulle quali si è depositato l’aerosol.
L’odontoiatra portatore del virus dell’epatite B può contagiare i pazienti, ad esempio, quando, durante un trattamento, si procura una ferita alle dita ed il sangue giunge nella cavità orale del paziente.
Eventualmente può anche avvenire una trasmissione attraverso la saliva dell’odontoiatra contenente il virus.
Una trasmissione da paziente a paziente avviene, infine, tramite veicoli contaminati quali strumenti o mani, nel caso in cui questi non siano stati opportunamente ripuliti, disinfettati e sterilizzati (Thraenhart, 1989).
2.2 Rischio di infezione da HCV
Circa il rischio di infezione da HCV gli studi di prevalenza degli anticorpi anti-HCV hanno evidenziato negli odontoiatri valori anche 5-10 volte maggiori rispetto ai gruppi di controllo rappresentati dai donatori di sangue (Bombarda, 1996).
Ricerche epidemiologiche hanno evidenziato come la prevalenza dell’infezione da HCV tra il personale medico e paramedico sia solo lievemente superiore rispetto alla normale popolazione.
Studi retrospettivi su soggetti esposti accidentalmente a sangue infetto per cause professionali hanno riportato una percentuale di sieroconversione variabile tra lo 0 e il 10%, molto inferiore cioè ai casi coinvolgenti l’HBV (10-30%).
È interessante notare che nella quasi totalità dei casi noti, l’esposizione al virus HCV è avvenuta a causa di puntura d’ago.
La frequenza di tale incidente nella pratica odontoiatrica, la presenza del virus nel sangue e nella saliva di pazienti HCV+, rendono l’HCV un potenziale agente della infezione crociata nell’ambulatorio odontoiatrico.
Alcuni studi condotti per valutare il rischio professionale dell’odontoiatra di infezione da HCV hanno fornito risultati abbastanza tranquillizzanti (Schiff, 1990; Klein, 1992; Herbert, 1992; Kuo, 1993) (tabella 2).
|
Autore |
Anno |
Paese |
Campione |
Prevalenza (%) |
|
|
Gruppo di studio |
Gruppo di controllo |
||||
|
Schiff |
1990 |
USA |
960 627 ausiliari + 333 odontoiatri |
1 1,4 0,3 |
¾ |
|
Klein |
1991 |
USA |
456 |
1,75 |
0,14 |
|
Herbert |
1992 |
UK |
94 |
0 |
0.3* |
|
Kuo |
1993 |
Taiwan |
461 |
0.65 |
0.95* |
*Donatori di sangue locali
Tabella 2: Prevalenza dell’infezione sostenuta da HCV in operatori odontoiatrici.
Le differenze riscontrabili sono presumibilmente legate ai diversi contesti sociali in cui gli studi hanno avuto luogo; la prevalenza maggiore è stata infatti registrata nell’area metropolitana di New York dove la percentuale di pazienti appartenenti a categorie a rischio è con ogni probabilità elevata.
2.3 Rischio di infezione da HIV
In campo odontoiatrico, relativamente alla trasmissione dell’HIV, l’attenzione va posta su due aspetti fondamentali:
- la possibilità di trasmissione diretta (o indiretta) da paziente ad odontoiatra e viceversa;
- l’eventuale trasmissione (in tal caso sempre indiretta) da un paziente all’altro, mediata dall’intervento dell’odontoiatra (attraverso lo strumentario).
In relazione a questi elementi, i dati da tener presenti per accreditare e quantificare il rischio di contrarre HIV (o di trasmetterlo) nell’esercizio della professione, sono i seguenti:
- l’infezione è scarsamente prevalente nella popolazione generale;
- l’infezione è altamente prevalente nei gruppi a rischio identificati (tossicodipendenti per via venosa, omosessuali, bisessuali, emofilici e politrasfusi prima del primo gennaio del 1986, partner sessuali dei soggetti citati, figli di sieropositive);
- l’infezione è prevalentemente asintomatica o paucisintomatica (è praticamente da escludersi che il malato di AIDS, con sindrome conclamata, richieda prestazioni ambulatoriali);
- ha tempo di incubazione medio/lungo (2 settimane - 6 mesi);
- tutti i soggetti infetti eliminano virus e sono pertanto portatori;
- la gravità dell’infezione è senz’altro molto elevata;
- la contagiosità sembra correlabile alle modalità di trasmissione: essa è elevata per i rapporti sessuali e per le emotrasfusioni (fino al 1986), mentre è piuttosto bassa per le altre evenienze che più si correlano al personale medico in generale (lesioni da siringa, infezione attraverso cute e mucose);
- il virus è scarsamente resistente ad agenti fisici e chimici.
Pertanto l’implicazione dell’odontoiatra, in merito al problema in oggetto, si concretizza nell’individuazione del paziente potenzialmente a rischio mediante il rilievo di manifestazioni iniziali della sindrome che si possono riscontrare a livello del cavo orale sottoforma di lesioni di varia natura che lo stomatologo ha la responsabilità di diagnosticare ed, inoltre, nell’adozione costante, nella gestione dello studio e nella pratica professionale, di rigide misure di protezione che non dovrebbero costituire novità, in relazione al problema AIDS, ma consuetudine ormai consolidata, conseguente alla conoscenza dei rischi infettivi, primo fra tutti quello dell’HBV (Ruggenini, 1988).
E’ ormai nota la maggiore contagiosità dell’infezione da HBV rispetto a quella da HIV, in relazione all’esposizione al sangue, eventualità questa possibile per il personale di assistenza in genere e frequente nel corso della pratica odontoiatrica.
3. LE MODALITA’ DI CONTAMINAZIONE DELLA STRUMENTAZIONE ODONTOIATRICA
Le modalità mediante le quali la strumentazione in possesso dell’ odontoiatra si contamina sono state oggetto di numerosi studi già a partire dagli anni ’60 (figura 3).

Figura 3: Dove cercare?
Oggi è sapere ormai consolidato che la contaminazione dell’intera attrezzatura avviene secondo due modalità:
a) contaminazione da parte di microrganismi provenienti dal paziente in corso di trattamento (contaminazione “acuta”);
b) contaminazione da parte di microrganismi provenienti dai condotti interni del riunito (contaminazione “cronica”) (Collegio dei Docenti di Odontoiatria e ADI, 2000).
3.1 Contaminazione da parte di microrganismi provenienti dal paziente in corso di trattamento
Gli agenti microbici presenti all’interno del cavo orale di un paziente sottoposto a trattamento, rimangono intrappolati all’interno di materiale organico adeso alla superficie esterna della strumentazione o vengono veicolati all’interno dei condotti degli strumenti, per poi venire espulsi all’esterno durante il successivo uso.
Il riunito cioè si comporta come un semplice veicolo, assolutamente passivo, attraverso il quale i microrganismi passano da un paziente all’altro nel corso dei vari interventi odontoiatrici.
Strumenti non monouso
Quando si parla di strumenti che vengono a contatto con agenti contaminanti presenti all’interno del cavo orale, si fa riferimento a tutti gli strumenti non monouso che vengono riutilizzati al termine di ogni intervento: in particolare, le frese per turbina e per manipolo a bassa velocità, le coppette per profilassi, le punte per apparecchio ad ultrasuoni, gli strumenti canalari, gli uncini portadiga, ma anche le superfici esterne degli strumenti rotanti e della siringa aria/acqua che vengono contaminate, anche nelle loro parti non in contatto con il cavo orale, attraverso il contatto con le mani protette dai guanti dell’operatore e con l’aerosol che da esse si sprigiona (figura 4) (Molinari, 1995; Molinari, 1999).
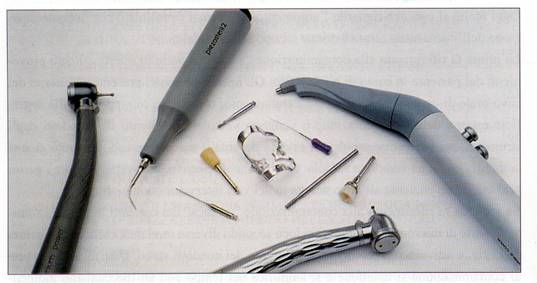
Figura 4: Alcuni strumenti non monouso normalmente utilizzati durante la pratica ambulatoriale.
I microrganismi in grado di contaminare la strumentazione sopra citata appartengono alle specie che normalmente possiedono il loro habitat all’interno del cavo orale o che in esso sono penetrati attraverso la saliva, il fluido crevicolare o il sangue.
Tra le specie virali più frequentemente presenti nel cavo orale e che possono essere fonte di contaminazione per l’intera strumentazione odontoiatrica, sono da annoverarsi i virus dell’epatite B, C e A, l’ HIV e gli Herpes virus di tipo 1 e 2 (Scott, 1997).
Gravi infezioni polmonari possono risultare dalla trasmissione di micobatteri tubercolari e non tubercolari (Griffiths, 1997; Hanson, 1988).
La sopravvivenza di un microrganismo sulla superficie di uno strumento odontoiatrico dipende non solo dalla resistenza del microrganismo, ma anche dalle condizioni ambientali in cui si trova confinato e cioè dalla presenza di materiale organico, di umidità, di aerazione e così via.
Il virus responsabile dell’AIDS ad esempio viene inattivato rapidamente sulle superfici di strumenti contaminati (riduzione del 99% entro poche ore) (CDC, 1987), mentre i virus dell’ epatite B e C possono sopravvivere fino a 7-9 giorni in presenza di una umidità superiore al 40% (Mosley, 1975; Bond, 1981; Piazza, 1995, b).
Lo stafilococco sopravvive su superfici secche fino a 5-7 giorni (Getchell-White, 1989).
Herpes virus possono sopravvivere dalle 3 alle 4 ore se intrappolati in gocce di saliva o di sangue e i rinovirus sopravvivono fino a 14 ore se mescolati a saliva (Thomas, 1985).
Il micobatterio della tubercolosi può addirittura sopravvivere fino a 8 mesi in gocce di saliva protette dalla luce del sole (Joklik, 1992).
Strumenti rotanti
La consapevolezza che uno strumento rotante viene continuamente contaminato, durante l’uso, da materiale proveniente dall’esterno, deriva dall’osservazione dell’interno di una turbina dopo alcuni mesi di utilizzo (figura 5).

Figura 5: Una turbina dopo alcuni mesi di utilizzo (Castellini S.p.A.).
Tale contaminazione avviene sia attraverso il contatto della superficie esterna dello strumento con il materiale contaminante, sia attraverso la penetrazione del materiale contaminante direttamente all’interno dei condotti dello strumento.
È noto che, nel momento in cui una turbina viene arrestata, si sviluppa una depressione nelle immediate vicinanze della fresa, la quale tende ad aspirare qualsiasi materiale posto nelle vicinanze verso l’interno della turbina stessa (Martin, 1987; Scheid, 1990; Lewis, 1992, a).
Una turbina può essere rappresentata come una camera contenente due distinti compartimenti: i condotti dell’acqua di raffreddamento formano il primo compartimento, la camera d’aria necessaria alla rotazione della fresa il secondo compartimento (figura 6).
|
|
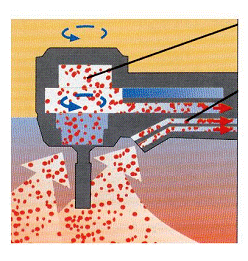
Figura 6: Schema dei compartimenti interni di una turbina.
In relazione al primo compartimento di una turbina (condotti dell’acqua di raffreddamento), numerosi autori hanno riportato allarmanti risultati relativi alla sua contaminazione da parte di materiale proveniente dall’ambiente esterno (Council on Dental Materials, Instruments and Equipment, 1988).
Secondo i dati ottenuti da Bagga nel 1984 (Bagga, 1984) circa 900 ml di fluido, contenente microrganismi, vengono aspirati all’interno dei condotti dell’acqua nel momento in cui il pedale di funzionamento di una turbina viene rilasciato (figura 7).

Figura 7: Strumento per misurare la retrazione di liquido.
Tale indagine ha mostrato che, all’interno dei condotti della turbina, la conta in CFU (colonie formanti unità) di microrganismi nell’acqua, variava tra 6 e 24.000 CFU/ml (6.360 CFU/ml in media), mentre la conta eseguita nei tubi di raccordo al riunito variava da 0 a 191.000 CFU/ml (54.000 CFU/ml in media).
Sommando le conte di entrambi i campioni di acqua si arriva ad una media di circa 60.500 CFU/ml. Anche altri agenti infettivi come virus della epatite, herpes virus, virus influenzali ed altri virus respiratori possono essere presenti.
Molti fattori, secondo i dati prodotti da Bagga, influenzano il numero di batteri aspirati all’interno dei condotti: la probabilità di retrarre grandi quantità di liquido contaminante è inversamente proporzionale alla distanza tra la testa della turbina e la superficie del liquido contaminante e, quindi, è influenzata dalla forma della turbina, dalla lunghezza della fresa nonché dalle particolari condizioni del campo operatorio.
Per quanto riguarda il secondo compartimento (camera d’aria), Lewis nel 1992 per primo ne documentò la contaminazione durante l’uso usando una soluzione colorata per simulare un contaminante esterno (Lewis, 1992, a).
La soluzione veniva collocata sia dentro i condotti dell’acqua di raffreddamento all’interno della turbina, sia sulla superficie esterna dello strumento.
Durante l’uso, si aveva la contaminazione della camera d’aria da parte sia della soluzione posta all’esterno della turbina, sia della soluzione iniettata nei condotti dell’acqua di raffreddamento.
Una volta contaminata, la camera d’aria fungeva da serbatoio ed il contaminante veniva lentamente rilasciato all’esterno attraverso gli spray durante il successivo uso.
Risultati simili sono stati ottenuti da Shpuntoff, Matsuyama e Checchi (Shpuntoff, 1993; Matsuyama, 1997; Checchi, 1998).
Siringa aria/acqua
La siringa aria/acqua è costantemente contaminata sulla superficie esterna durante tutti i tipi di intervento odontoiatrico.
Le superfici esterne entrano infatti immancabilmente in contatto con saliva, sangue e altri contaminanti.
Tuttavia esiste un’altra possibilità di contaminazione, ben documentata, che fa riferimento ai condotti interni della siringa stessa.
Studi clinici e microbiologici hanno dimostrato che i microrganismi, una volta contaminata la parte terminale della siringa, risalgono per capillarità i condotti interni aria/acqua compresi dentro la siringa (Merchant, 1983; Quinley, 1989).
Il fenomeno comporta da un lato la colonizzazione, mediante la formazione di biofilm, dei condotti interni della siringa nel momento in cui non venga utilizzata per lunghi periodi di tempo e dall’altro l’ingresso di microrganismi per via retrograda nei condotti dell’acqua, determinando una contaminazione di parti non facilmente raggiungibili e contribuendo al mantenimento ed alla espansione dei biofilm presenti all’interno del riunito (Martin, 1998).
Condotti interni del riunito
La contaminazione dei condotti interni del riunito ad opera di microrganismi provenienti dal paziente in corso di trattamento rappresenta un momento successivo all’ingresso degli agenti microbici negli strumenti rotanti o nella siringa aria/acqua.
Come descritto in precedenza, i microrganismi, una volta aspirati all’interno della strumentazione collegata al riunito, con movimenti retrogradi sono in grado di penetrare rapidamente entro i condotti e da qui venire espulsi durante il successivo uso (Martin, 1998).
La rapida penetrazione di agenti patogeni all’interno dei condotti del riunito acquista una notevole importanza in quanto invalida la sterilizzazione della strumentazione rotante o della siringa aria/acqua visto che la contaminazione microbiologica è già risalita a monte degli strumenti stessi (figura 8).
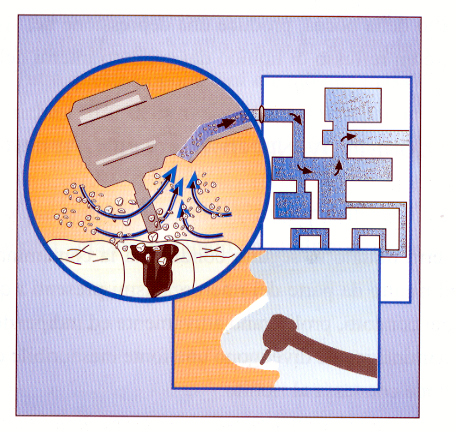
Figura 8: Meccanismo di contaminazione dei condotti idrici interni del riunito con microrganismi penetrati attraverso gli strumenti caudati.
Aspira saliva a bassa pressione
Oggi si è a perfetta conoscenza che, in una struttura odontoiatrica in cui molti riuniti funzionano contemporaneamente, nel circuito aspirasaliva si producono variazioni importanti della pressione che possono favorire il reflusso di liquido nella bocca del paziente.
La possibilità che tale liquido sia contaminato da microrganismi provenienti da vari pazienti sottoposti a precedenti trattamenti risulta ovvia (Mann, 1996).
Le variabili più importanti nel condizionare il reflusso sono oltre all’utilizzo contemporaneo di altri sistemi di aspirazione anche il posizionamento del tubo aspira saliva che, incarcerato all’interno della bocca dalla chiusura delle labbra del paziente, produce una depressione nel sistema di aspirazione a cui può conseguire un reflusso di liquido dai condotti interni del tubo di aspirazione (Watson, 1993).
3.2 Contaminazione da parte di microrganismi provenienti dall’acqua di alimentazione
La seconda possibile fonte di microrganismi nei circuiti idrici del riunito è rappresentata dall'acqua di alimentazione, fornita dall'acquedotto (acqua potabile).
Essa dovrebbe avere una carica batterica estremamente contenuta, con totale assenza di batteri patogeni, quali Pseudomonas, Legionelle.
Ciò non significa che l'acqua potabile sia necessariamente sterile, anzi può contenere una flora microbica varia che, per tipo e concentrazione, è generalmente innocua per l'uomo (figura 9).
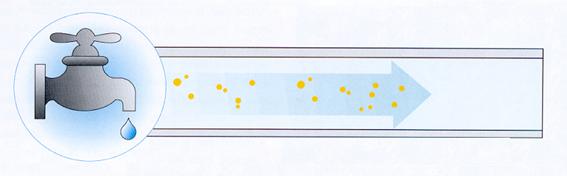
Figura 9: Possibile contaminazione da acqua potabile.
In particolari condizioni, però, dalla rete dell'acqua potabile possono giungere al riunito dentale anche microrganismi patogeni o patogeni opportunisti, come si ricava dall'elenco dei microrganismi di provenienza acquatica isolati nell'acqua erogata dai riuniti (Williams J.F., 1996).
Microrganismo |
Patogenicità |
Patologie correlate |
|
Achromobacter |
bassa |
ascessi |
|
Acinetobacter |
opportunista |
setticemia, ferite infette |
|
Alcaligenes |
opportunista |
ascessi, setticemia |
|
Bacillus |
bassa |
|
|
Caulobacter |
opportunista |
|
|
opportunista |
polmonite |
|
|
patogeno primario |
malattia del Legionario |
|
|
Micrococcus |
bassa |
|
|
Mycobacterium avium |
opportunista |
chronic granulomatous lung disease |
|
Ochromobacterium |
|
|
|
Pasteurella spp |
opportunista |
infezioni respiratorie croniche, ferite infette |
|
Proteus vulgaris |
? |
infezioni del tratto urinario |
|
Pseudomonas aeruginosa |
opportunista |
setticemia, ascessi, infezioni respiratorie e ferite infette |
|
Pseudomonas cepacia |
opportunista |
polmonite, otite, ferite infette |
|
Xanthomonas |
bassa |
infezioni respiratorie croniche, ferite infette |
|
Pennicillium |
allergenico, raro opportunista |
reazioni allergiche respiratorie |
|
Cladosporium |
allergenico, raro opportunista |
reazioni allergiche respiratorie |
|
Alternaria |
allergenico, raro opportunista |
reazioni allergiche respiratorie |
|
Scopulariopsis |
allergenico, raro opportunista |
reazioni allergiche respiratorie |
Tabella 3: Microrganismi acquatici isolati nell’acqua dei riuniti
(Williams J.F., 1996).
D'altra parte va sottolineato che la carica batterica delle acque ambientali viene controllata all'origine mediante controlli microbiologici su campioni prelevati a monte del bacino di utenza.
La qualità microbiologica dell'acqua registrata "alla fonte" dall'Ente erogatore, non corrisponde però necessariamente alla qualità microbiologica rilevabile nelle sedi più prossime al riunito.
Infatti, le analisi di campioni di acqua provenienti dalla rete idrica ma prelevati immediatamente a monte del riunito hanno dato valori di cariche batteriche notevolmente superiori ai criteri di potabilità, fino a livelli ritenuti decisamente inadeguati per l'impiego clinico.
3.3 Contaminazione da parte di microrganismi provenienti dai condotti interni del riunito: il biofilm
La contaminazione “cronica” dei condotti interni del riunito da parte di microrganismi giunti in loco sia dal cavo orale del paziente sia dall’acqua dell’acquedotto, si mantiene e si amplifica nel tempo con un meccanismo indipendente dall’impiego dell’attrezzatura sul paziente e trasforma il riunito odontoiatrico in un serbatoio permanente di agenti microbici organizzati in una struttura denominata biofilm (Abel, 1971; Association Reports, 1978) (figura 10).
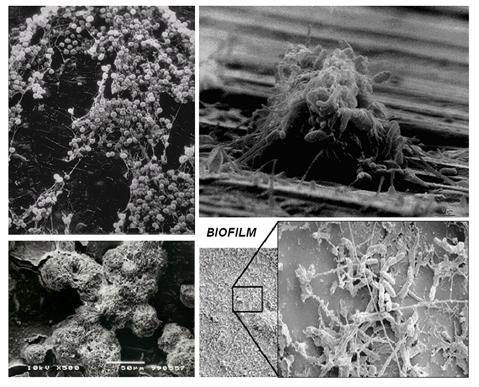
Figura 10: Microscopia elettronica del biofilm.
Per biofilm si intende una entità costituita da molecole idrofobiche ad alto e basso peso molecolare (slime) e batteri adesi a queste e fra di loro, che si produce lungo le pareti interne dei lunghi e stretti tubi che forniscono l’acqua di irrigazione e di raffreddamento agli strumenti e che da questi può eventualmente staccarsi giungendo fino al campo operatorio (Mayo, 1990; Smith, 1999; Williams J.F., 1993) (figura 11).

Figura 11: Rappresentazione sessile di un biofilm su substrato.
Occasionalmente questi aggregati batterici liberano singole cellule che si disperdono e si moltiplicano rapidamente colonizzando altri siti.
Lo slime può inoltre intrappolare componenti di diversa natura quali materiali organici, cellule morte o sostenze minerali precipitate.
Il biofilm presenta inoltre ben precise proprietà chimiche (pH, potenziale redox, conduttività, gradiente di concentrazione di prodotti batterici), fisiche (resistenza termica, idraulica, densità, proprietà ottiche e spettroscopiche) e fisiologiche (attività idrolasiche, idrogenasiche, della catena respiratoria, ATP, luminescenza, proprietà genetiche), proprietà che variano a seconda della popolazione batterica che lo costituisce.
Il processo di adesione microbica si articola in una prima fase definita ”attacco reversibile” ed in una fase finale definita “attacco irreversibile”.
Nel primo stadio l'adesione è ancora reversibile e per rimuovere i microrganismi è sufficiente un abbondante risciacquo, successivamente, l'adesione dei microrganismi diviene molto tenace grazie alla presenza di appendici quali flagelli, fimbrie, pili.
L’idea generale è che ciascun batterio (fase planktonica) è esposto agli agenti ambientali (per esempio alla possibilità di essere fagocitato o trascinato da un fluido) mentre all’interno di un biofilm (fase sessile) si trova protetto (Costerton, 1999) (figura 12).
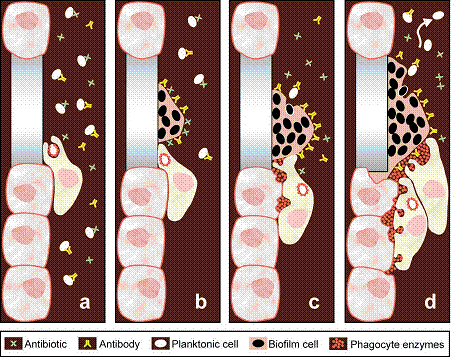
Figura 12: Nel biofilm i batteri sono anche 1000 volte più resistenti che in forma planktonica (Costerton, 1999).
Un biofilm è quindi formato da cellule batteriche vitali in continua crescita o morte, da esopolisaccaridi e da eventuali sostanze organiche o inorganiche intrappolate; la sua formazione si realizza attraverso un lento processo, che tuttavia può portare alla formazione di masse dello spessore di qualche millimetro in pochi giorni (Melo, 1992); inoltre presenta una curva di crescita sigmoidale del tutto simile ad una comune curva di crescita batterica.
Generalmente i biofilm formati da colonie eterogenee sono più spessi e più stabili di quelli monospecie ed il numero di batteri che comunemente si riscontra in un biofilm maturo risulta essere estremamente elevato: fra 107 e 109 cellule/cm2 (Siebe1, 1991).
Esiste una lunga lista di microrganismi che sono stati via via isolati dal biofilm dei condotti interni del riunito; tra questi numerose specie di Gram- saprofiti dell’acqua (Caulobacter, Flavobacterium), Legionelle, Acanthamoebae, Mycobacterium avium, oltre a Gram+ (Stafilococchi, Streptococchi ed Enterococchi) la cui presenza testimonia una contaminazione proveniente dal cavo orale dei pazienti (Williams H.N., 1996).
Le modalità di formazione del biofilm sono oggi perfettamente conosciute.
In seguito all’immersione di una qualsiasi superficie solida in una soluzione acquosa, molecole idrofobiche contenute nella soluzione iniziano ad agglomerarsi lungo la parete del solido formando un sottile strato traslucido (Costerton, 1987; Marshal, 1992).
La formazione dello strato altera le caratteristiche della superficie del solido ed esalta le proprietà di adesione proprie di alcune specie batteriche.
Durante tutto il processo di adesione, la formazione del biofilm diventa da reversibile ad irreversibile, nel momento in cui i microrganismi si organizzano ed iniziano a moltiplicarsi.
Vengono così a formarsi popolazioni eterogenee di batteri, interagenti l’una con l’altra e formanti microcolonie di numerose specie e generi. Tutte queste popolazioni creano una massa appiccicosa composta da colonie batteriche (10% della massa fangosa) separate da acqua contenente sostanze altamente nutritive oltre a prodotti del catabolismo batterico (90% della massa fangosa).
La propagazione della massa di biofilm ora avviene rapidamente fino a 100 cm in linearità nell’arco di 3 giorni, grazie al rapido moltiplicarsi delle specie ivi presenti (Characklis, 1990).
Il processo che porta all’agglomerazione e all’accumulo di diverse specie di microrganismi nel biofilm è facilmente osservabile in numerosi e diversi ecosistemi esistenti in natura, in quanto la partecipazione a comunità aderenti l’una all’altra è un normale “modus vivendi” adottato da quasi tutte le specie batteriche (Marshall, 1994).
Con l’inizio dell’utilizzo dei manipoli, poche unità di microrganismi entrano nei condotti interni del riunito, sia attraverso l’acqua proveniente dai condotti idrici di alimentazione esterna, sia attraverso i liquidi aspirati dalla bocca del paziente sottoposto a trattamento.
I microrganismi, dopo poche decine di minuti formano agglomerati (biofilm) sempre più tenacemente adesi alle pareti interne dei tubi entro i quali si moltiplicano e sono pronti ad essere emessi all’esterno attraverso gli spray. Il flusso ininterrotto degli spray riduce la concentrazione di microrganismi negli spray stessi ma non è in grado di eliminare il biofilm che rimane adeso ai tubi.
Pochi minuti di sosta ed i microrganismi ricominciano a riprodursi e il ciclo ricomincia (Whitehouse, 1991).
Non vi è dubbio che i germi aspirati dalla bocca del paziente all’interno dei condotti idrici del riunito possano essere una causa importante nella formazione ed espansione del biofilm, esiste comunque un'altra causa, forse la più importante, ed è l’acqua proveniente dall’acquedotto.
L’acqua di rete, come è noto, non è esente da contaminazione batterica, anche se i livelli di contaminazione sono generalmente inferiori a 100 CFU/ml. Le condizioni ambientali presenti all’interno dei condotti del riunito dentale, risultano però estremamente favorevoli per una loro adesione e proliferazione così che, in un breve periodo di tempo, le poche colonie di microrganismi presenti nell’acqua di rete si moltiplicano e acquistano un significato rilevante all’interno dei condotti del riunito.
Ciò è dimostrato dalla constatazione che l’acqua che fuoriesce dagli spray contiene specie batteriche che non sono normalmente riscontrabili nel cavo orale di soggetti della specie umana (Williams J.F., 1996).
Se è facile dimostrare che l’acqua proveniente dai riuniti è immancabilmente contaminata da innumerevoli specie microbiche, è però molto difficile dimostrare una relazione netta tra la presenza di contaminazione dell’acqua degli spray e la diffusione di malattie nella popolazione che si sottopone a trattamenti odontoiatrici.
Infatti pur essendo relativamente agevole associare alcuni disordini acuti (gastroenteriti, infezioni da herpes, ecc.) ad una prestazione odontoiatrica eseguita nell’immediata precedenza, risulta alquanto difficile farlo nel caso di malattie con un lungo periodo di incubazione.
Inoltre occorre considerare che gran parte dei microrganismi isolabili dai condotti interni del riunito pur non essendo sprovvisti di elevata patogenicità, possono diventare straordinariamente aggressivi in caso di soggetti immunocompromessi; questo è un elemento che va preso in seria considerazione in quanto soggetti con alterazioni immunitarie fisiologiche legate all’età o patologiche legate a malattie debilitanti, sono in crescente aumento nella popolazione che frequenta gli studi odontoiatrici (Williams J.F., 1996).
Da quanto detto si intuisce, che il problema della contaminazione crociata paziente-paziente è molto più complesso di quanto si possa immaginare.
Tuttavia l’esistenza di un rapporto tra patologia infettiva e trattamento odontoiatrico è stato più volte dimostrato e riportato in letteratura.
Il ruolo della contaminazione del riunito nella diffusione di malattie si può comprendere bene se si prendono in considerazione alcuni casi emblematici documentati, come quelli di Martin nel 1987 (Martin, 1987): due casi di infezioni gravi da Pseudomonas in due soggetti sottoposti a trattamento odontoiatrico conservativo.
Un’altra specie batterica divenuta il simbolo della dimostrazione che i condotti interni del riunito sono contaminati e possono essere responsabili della trasmissione di infezioni, è la Legionella (Oppenheim, 1987; Reinthaler, 1986).
Oppenheim nel 1987 (Oppenheim, 1987) riportò l’isolamento di Legionella nel 50% dei campioni provenienti dagli spray di siringhe aria/acqua e di strumenti rotanti.
Percentuali intorno al 10% sono state riportate da Reinthaler nel 1986 (Reinthaler, 1986), attorno al 40% da Borneff nel 1986 (Borneff, 1986) e attorno al 30% da Simonetti nel 1992 (Simonetti, 1992).
Atlas nel 1995 (Atlas, 1995) segnalò percentuali di positività vicine al 70%, di cui l’8% rappresentato da Legionella pneumophila, specie altamente patogena per l’uomo e responsabile della polmonite del legionario.
Williams nel 1996 (Williams H.N., 1996) studiò 47 riuniti odontoiatrici installati presso una clinica odontoiatrica del Maryland; nel 62% dei riuniti egli riscontrò la presenza di Legionella e nel 19% concentrazioni superiori alle 100 unità/ml.
La dimostrazione che l’acqua dei condotti interni del riunito è un potenziale serbatoio di diffusione di tale microrganismo trova la sua espressione nella elevata concentrazione di anticorpi anti-legionella più volte riscontrati nel personale addetto agli studi odontoiatrici (Fotos, 1985; Reinthaler, 1988; Luck, 1991).
Reinthaler nel 1988 (Reinthaler, 1988) riscontra nel personale odontoiatrico una siero-positività alla Legionella pneumophila del 50% circa, mentre solo il 5% del gruppo di controllo (personale non medico) risultava positivo; i dentisti avevano la più alta prevalenza (>50%), seguiti dalle assistenti alla poltrona (38%) e dai tecnici di laboratorio (20%).
Questi dati però non sono mai stati correlati con una maggior incidenza di patologia da legionella negli operatori odontoiatrici, se si esclude un caso di polmonite mortale, segnalato in un odontoiatra, di cui era responsabile una specie di legionella isolata sia nei polmoni del professionista che all’interno del riunito su cui egli operava (Mackenzie, 1994).
Occorre tuttavia considerare che le manifestazioni cliniche della malattia da legionella sono molteplici e difficili da quantificare.
Infatti, accanto alle gravi patologie polmonari (polmonite dei legionari) la legionella è in grado di provocare anche infezioni locali da inoculo del microrganismo (Lowry, 1991), disturbi aspecifici (malattia di Pontiac) caratterizzati da fenomeni allergici, infezioni dell’apparato respiratorio simil-influenzali, ecc (Paszko-Kolva, 1991; Miller L.A., 1993).
I casi sin qui esposti sono emblematici e portati ad esempio del ruolo della contaminazione del riunito nella diffusione di malattie, ma esistono anche altri studi che supportano tale teoria: ad esempio molte specie batteriche contaminanti il riunito sono ritenute oggi responsabili di infezioni acute del tratto gastrointestinale (Payment, 1991).
Lo Pseudomonas fluorescens, una specie normalmente contaminante i condotti interni del riunito, può essere causa di malattie mortali (Williams J.F., 1993).
Infine, episodi fatali di polmoniti sono stati messi in relazione con infezioni comparse in seguito a trattamenti odontoiatrici (Ely, 1993).
In campo odontoiatrico il fenomeno dell'airborne infection si colloca in una condizione operativa unica: nel caso dell'odontoiatria, diversamente dalle altre attività cliniche o chirurgiche, le prolungate aerosolizzazioni tipiche del trattamento odontoiatrico, prodotte dall'utilizzo clinico degli strumenti dinamici, causano la diffusione in aria di particelle infette ed infettanti di piccole dimensioni, in misura notevolmente superiore ad ogni altra attività medica (Dolci, 2002) (figura 13).
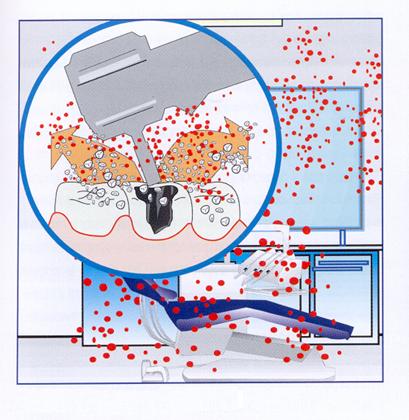
Figura 13: Aerosol con possibile contaminazione.
La rapida rotazione della fresa della turbina o di altro strumento rotante, come pure la forza impressa dalla vibrazione delle punte ad ultrasuoni, in associazione con lo spray dello strumento o della siringa, provocano infatti la proiezione nell'aria circostante il campo operatorio di pulviscoli e nebbie contaminati provenienti dal cavo orale del paziente sottoposto a cura, con una diffusione di aerosol contenenti saliva, sangue, detriti dentali, placca dentale e materiali da otturazione.
Ne risulta un vero e proprio inquinamento biologico dell'aria dello studio dentistico, con conseguente rischio di airborne infection.
Per via aerea, quindi, questi contaminanti aerodispersi possono giungere a contatto con la cute, le mucose orali, le vie respiratorie e gli occhi dell'operatore, ma possono anche depositarsi sulle superfici delle attrezzature, sugli arredi e sui pavimenti all'interno dell'ambulatorio dentistico.
La cross-infection per trasmissione aerea si può quindi verificare in linea generale secondo due diverse modalità: o come infezione diretta, per contatto o inalazione, oppure per contaminazione delle superfici dello studio da parte di particelle infette, ivi depositate dopo un tragitto più o meno breve in aria.
La diffusione delle particelle più piccole e leggere, gli aerosol, è difficile da prevedere, giacché subordinata a numerose variabili locali: microcorrenti, abitudini di lavoro diverse, planimetria dello studio dentistico ed altro. Vero è che, in talune situazioni, i contaminanti aerotrasportati possono essere ritrovati anche in ambienti distanti dall'area operativa (Dolci, 2002).
La formazione massiva di aerosol infetti durante l'utilizzo dei manipoli rotanti, per lo più ad alta velocità quali le turbine, è stata dimostrata da due studi condotti da Tonne (1977) e Bentley (1994). Nel primo lavoro l'Autore pone la sua attenzione sull'elevato rischio legato alla diffusione per via aerea di agenti infettivi provenienti dal cavo orale dei pazienti e sulla facilità con cui possono diffondere nell'ambiente circostante. A tali considerazioni è giunto anche l'Autore del secondo studio che ha evidenziato un considerevole aumento della concentrazione di batteri nell'aria indoor durante e dopo il trattamento (Tonne, 1977; Bentley, 1994).
Infine, particolarmente significativo è un lavoro condotto da Miller R.L. (1995), che ha analizzato le caratteristiche del sangue contenuto all'interno degli aerosol prodotti dall'utilizzo dei comuni manipoli odontoiatrici. L'Autore afferma che durante l'impiego di questi strumenti si generano aerosol contenenti frammenti di globuli rossi ed emoglobina.
Le particelle più piccole possono "ospitare" diversi agenti infettivi, quali virus dell'epatite B, C, HIV, e nel momento in cui vengono inalate permangono all'interno dell'apparato respiratorio raggiungendo anche il torrente circolatorio polmonare (Miller R.L., 1995).
Le normali prassi di pulizia/disinfezione di superficie possono soltanto agire sugli accumuli microbici già depositati, riducendone il pericolo per contatto e per diffusione secondaria, ma certamente non possono in alcun modo influire sulla generazione e diffusione primaria degli aerosol infetti.
Per incidere sui fattori primari di rischio si dovrà agire sia sulla generazione degli aerosol infetti ricorrendo a sistemi disinfettanti, sia sulla loro diffusione, innanzitutto confinando le zone operative e quindi intervenendo con sistemi di captazione, evacuazione e ricambio dell'aria indoor.
3.5 Contaminazione della linea pneumatica e dei dispositivi aspiranti
Una contaminazione biologica può essere già presente nel flusso di aria compressa che giunge al riunito, causata da microrganismi ambientali prima entrati nel compressore e poi accumulatisi e moltiplicatisi nel serbatoio dell'aria ove l'umidità, la temperatura e l'assenza di luce selezionano e favoriscono la sopravvivenza di alcune specie microbiche come le muffe. Anche i dispositivi aspiranti possono divenire un'area ad alta contaminazione a causa del transito dei fluidi organici aspirati e alla loro deposizione sulle componenti che costituiscono i dispositivi stessi (figura 14).
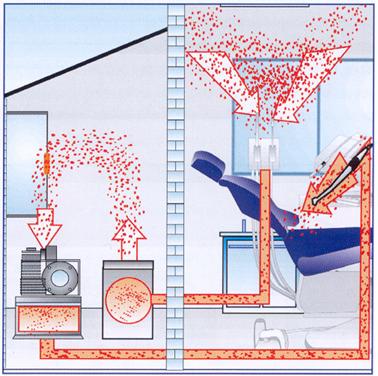
Figura 14: Aspirazione, compressione e possibile contaminazione.
Vi sono poi i dispositivi aspirasaliva nei quali un flusso di acqua all'interno di un eiettore crea un'aspirazione di discreta prevalenza ma di bassa portata. In questi dispositivi si genera una confluenza critica fra la linea idrica e la linea di aspirazione, con conseguenze preoccupanti sul piano igienico giacché l'elevata contaminazione del flusso aspirato dal cavo orale, contenente sangue e saliva, può facilmente diffondersi alla linea idrica interna al riunito e da qui alla linea dell'acqua di rete.
4. La prevenzione dellE infezioni crociate
Negli anni recenti alcune industrie odontoiatriche si sono rese protagoniste di tutta una serie di innovazioni che hanno permesso un maggiore controllo della contaminazione dell’attrezzatura dell’odontoiatra.
In particolare sono stati progettati dei sistemi in grado di controllare la contaminazione del riunito durante un intervento odontoiatrico e nelle pause tra un intervento e l’altro, con dispositivi in grado di opporsi all’aspirazione di materiale contaminante dal cavo orale del paziente, di opporsi in modo permanente alla formazione del biofilm all’interno dei condotti idrici ed in grado di controllare la contaminazione in uscita dal riunito attraverso gli spray.
Inoltre la ricerca è orientata anche alla messa a punto di test rapidi per l’identificazione precoce del paziente infetto.
Questo aumenta nell’odontoiatra la sensibilità e la disponibilità alla prevenzione della contaminazione crociata e favorisce l’applicazione di tutte le procedure atte ad eliminare l’agente infettivo.
4.1 Riduzione della contaminazione del riunito
Controllo della contaminazione in entrata, durante un intervento odontoiatrico
Come detto in precedenza, sono state analizzate due possibilità mediante le quali un contaminante esterno può essere aspirato all’interno delle attrezzature e quindi finire per contaminare i condotti interni: la contaminazione della camera d’aria della turbina e la contaminazione dei condotti dell’acqua di raffreddamento.
Su questi due distinti settori si è rivolta l’attenzione di certe industrie odontoiatriche, le quali hanno recentemente fornito all’operatore alcuni dispositivi atti a ridurre l’aspirazione di materiale infetto dal cavo orale del paziente sottoposto a trattamento.
Nell’ambito della contaminazione interna dei condotti dell’acqua di raffreddamento già nel 1978 Crawford (Crawford, 1978) proponeva un sistema capace di opporsi all’aspirazione di liquidi, attraverso l’applicazione di valvole, denominate antireflusso, che scattavano al momento dell’arresto della turbina e che si opponevano così all’aspirazione di liquido (figura 15).
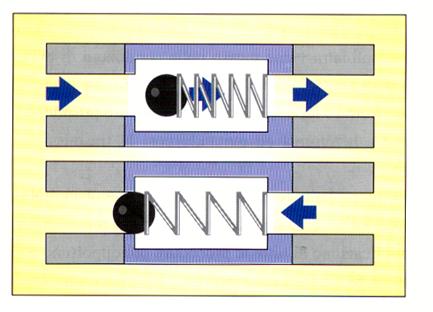
Figura 15: Schema di funzionamento di una valvola antireflusso.
La validità di tali sistemi fu dimostrata in maniera scientifica da Bagga nel 1984 (Bagga, 1984), il quale quantificò l’aspirazione di microrganismi dal cavo orale del paziente all’interno del riunito, in presenza o in assenza di valvole antireflusso.
In assenza di valvole egli dimostrò un elevata contaminazione dei condotti interni dell’acqua. L’aggiunta di valvole antireflusso riduceva in maniera significativa tale contaminazione batterica.
Veniva così determinata la reale efficacia di tali dispositivi e sottolineata la possibilità di ridurre di ben 4000 volte la quantità di microrganismi aspirati durante l’uso di uno strumento rotante.
Attualmente molti riuniti dentali sono provvisti di valvole antireflusso operanti sui condotti dell’acqua, va però tenuto presente che una volta installate necessitano di una regolare e routinaria manutenzione (figura 16): devono essere regolarmente controllate e periodicamente sostituite, in conformità alle direttive dell’American Dental Association, che stabiliscono che il reflusso di liquido all’interno del riunito non debba superare i 50 ml, cioè la lunghezza del manipolo (ADA, 1996).
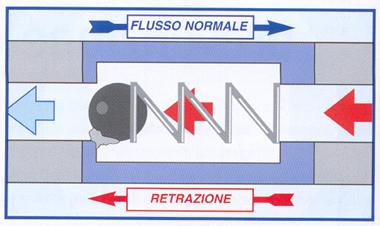
Figura 16: Malfunzionamento di una valvola antireflusso per depositi.
Anche per la contaminazione della camera d’aria della turbina l’industria ha prodotto sistemi atti a ridurne la portata.
Nel 1996 Ojajarvi (Ojajarvi, 1996) osservò che nelle turbine allacciate a riuniti sprovvisti del sistema antireflusso si verificava la crescita di batteri in ben 10 test su 150, mentre nessuna crescita colturale si verificava nelle turbine allacciate a riuniti provvisti di tali sistemi antireflusso.
Ben presto altri studi diedero riscontri analoghi sottolineando l’importanza dei sistemi antireflusso.
Recentemente due industrie odontoiatriche hanno equipaggiato i loro riuniti con sistemi antireflusso, per quanto riguarda i condotti dell’aria, basati su due concetti assolutamente differenti l’uno dall’altro.
Il primo sistema, applicato direttamente nella turbina, consiste in una valvola meccanica, posta nel condotto dell’aria all’interno della turbina, che scatta nel momento esatto in cui il pedale di funzionamento viene rilasciato, chiudendo i condotti interni e quindi impedendo il passaggio di contaminante lungo i condotti interni dell’aria (figura 17).
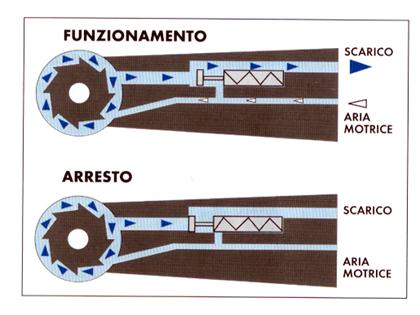
Figura 17: Sistema antireflusso montato su turbina.
Il secondo sistema, direttamente installato all’interno del riunito, funziona aumentando in maniera automatica la pressione dell’aria all’interno dei condotti nel momento in cui la turbina si ferma, opponendosi così, attraverso la creazione di una barriera ad alta pressione, all’ingresso di liquidi dall’esterno all’interno della camera della turbina stessa (figura 18).
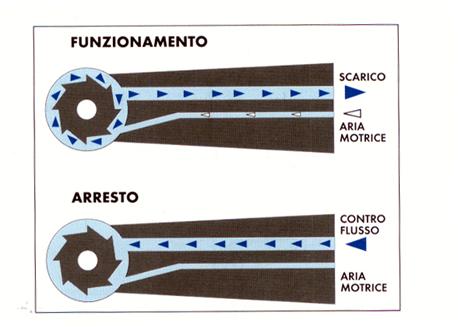
Figura 18: Sistema antireflusso montato su riunito.
I risultati di un recente studio hanno confermato l’efficacia di entrambi i sistemi mostrando che in condizioni sperimentali molto vicine a quelle reali, quando cioè la testa della turbina è mantenuta ad una discreta distanza dalla superficie del liquido contaminante, si ottiene una notevole riduzione della contaminazione dei condotti delle turbine provviste di questi sistemi antireflusso.
Quando la testa della turbina viene mantenuta in stretto contatto con la superficie del liquido, durante l’arresto della fresa, i due sistemi sono ancora in grado di garantire una riduzione della contaminazione delle camere d’aria, soprattutto il sistema antireflusso integrato nel riunito (Montebugnoli, 2000, a).
Controllo della formazione del biofilm all’interno del riunito
Per ostacolare la formazione di biofilm all’interno delle tubazioni idriche del riunito la ricerca tecnologica ha permesso di mettere a punto diversi sistemi.
Tra questi, un dispositivo, detto di antiristagno, integrato nel riunito odontoiatrico, in grado di fare circolare in maniera continua l’acqua all’interno delle tubazioni evitando fenomeni di ristagno durante le pause di lavoro.
L’efficacia di tale sistema, nel mantenere ridotta nel tempo la contaminazione microbica all’interno delle tubazioni, è stata valutata in un recente studio clinico-microbiologico che ha mostrato come la presenza di tale dispositivo diminuisce la contaminazione dell’acqua in uscita dagli spray. Infatti nei riuniti muniti di dispositivi antiristagno la concentrazione di batteri negli spray risultava inferiore di 15-30 volte rispetto a quelli sprovvisti di tali dispositivi (Montebugnoli, 2000, b).
Un altro passo avanti per la prevenzione della formazione del biofilm all’interno del riunito è stato fatto nell’ambito della alimentazione idrica del riunito.
Nella prospettiva di eliminare tale fonte di contaminazione sono stati progettati sistemi in grado di isolare il riunito dall’acqua di rete. Alcune industrie hanno infatti dotato i riuniti di dispositivi in grado di fare circolare, in tutte le tubazioni interne, soluzioni prelevate da recipienti interni al riunito stesso (Figura 19).
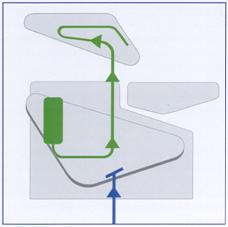

Figura 19: Alimentazione indipendente dalla rete idrica.
Vengono così utilizzati recipienti con soluzioni sterili assolutamente indipendenti dall’acqua di rete le quali, una volta messe in pressione, sono mandate in circolo ed emesse all’esterno attraverso gli strumenti rotanti e le siringhe aria/acqua.
Altre industrie hanno costruito soluzioni che adottano lampade a scarica in vapore di mercurio a bassa pressione (del tipo delle lampade a fluorescenza) che emettono una luce UV-C con lunghezza d'onda intorno a 250 nm (figura 20). Le radiazioni ultraviolette vengono comunemente applicate per le procedure di asepsi di ambienti, superfici, materiali e liquidi grazie alla loro azione biocida sui microrganismi ed all'azione di blocco della divisione cellulare.
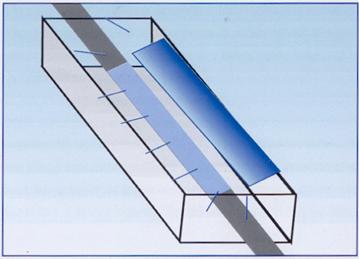
Figura 20: Lampada UV-C applicata ad un condotto idrico.
Tuttavia, per l'applicazione all'alimentazione idrica del riunito, l'efficacia di un trattamento UV è fortemente condizionata da diversi fattori: intensità della emissione (Watt per cm2), irraggiamento dei microrganismi e tempo di esposizione. Per questi aspetti occorre tenere in conto la trasparenza del condotto irraggiato, la torbidità dell'acqua, la presenza di solidi sospesi e precipitati che possono proteggere i microrganismi per "effetto ombra", la velocità di flusso nel condotto irraggiato e quindi il reale tempo di esposizione ed, infine, la resistenza di alcune importanti specie acquatiche patogene.
Un altro mezzo per contrastare la presenza di contaminanti nel circuito idrico, sia provenienti da paziente sia da rete idrica, è la cosiddetta "attivazione elettrolitica" dell'acqua (figura 21). Una applicazione di questo genere è costituita da una cella elettrolitica nella quale una soluzione di Cloruro di Sodio (salamoia) è sottoposta ad elettrolisi, con generazione di radicali fortemente ossidanti ed in elevata concentrazione, quindi capaci di esercitare un'azione biocida. Sistemi di questo tipo sono stati impiegati nelle procedure di asepsi degli endoscopi e nella rimozione del biofilm nel circuito idrico del riunito con buoni risultati: una rapida e ampia azione biocida, dai batteri alle spore, analogamente a quanto ottenuto usando acido peracetico, però con la limitazione dell'interferenza data dalle sostanze organiche.
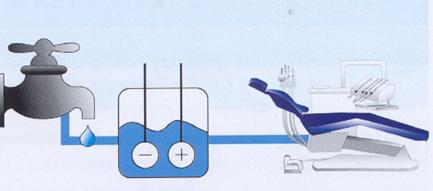
Figura 21: Attivazione elettrolitica dell’acqua.
Per cercare di migliorare il livello di qualità microbiologica dell'acqua utilizzata sul campo operatorio con gli strumenti dentali, negli U.S.A. è stato da tempo proposto l'obbiettivo di contenere la carica batterica dell'acqua del riunito entro le 200 CFU/ml (ADA, 1996), un obiettivo che più recentemente è stato ridimensionato ritenendo accettabile che nel riunito vi sia un'acqua con carica batterica fino a 500 CFU/ml (CDC, 2003).
Per perseguire questo obiettivo e considerando che, in un modo o nell'altro, il circuito idrico viene sempre contaminato, le linee guida emanate dal Centers for Diseases Control, dalla American Dental Association e dalla British Dental Association concordano sul fatto che il circuito del riunito debba essere “flussato” completamente per "diversi minuti" azionando a vuoto ciascuno strumento, all'inizio di ogni giornata lavorativa e prima di ogni intervento (figura 22).
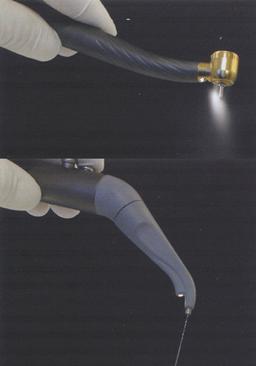
Figura 22: Flussaggio di strumenti caudati.
Questa azione di spurgo dovrebbe ridurre l'accumulo microbico conseguente al ristagno notturno o alle pause di inattività che caratterizzano il normale impiego clinico del riunito ed infine ridurre la carica batterica dell'acqua.
Il flussaggio, però, non ha alcun effetto sul biofilm, sia per le caratteristiche intrinseche di quest'ultimo, sia perché il flusso nei condotti avviene con moto laminare, cioè con uno strato liquido virtualmente stagnante in stretta prossimità delle pareti dei condotti, laddove si trova il biofilm (Williams J.F., 1993).
Nuovi materiali, con proprietà anti-batteriche o anti-adesione, sono stati studiati negli ultimi anni per l'applicazione nel circuito idrico del riunito odontoiatrico. Questo particolare orizzonte di ricerca si è aperto in seguito alle positive esperienze condotte in altre discipline medico-chirurgiche, per evitare la contaminazione di cateteri vascolari o di sistemi di drenaggio.
Il problema dipende dal fatto che i materiali cosiddetti inerti, con cui sono realizzati quei dispositivi, inerti non sono affatto rispetto all'insediamento dei microrganismi sulla loro superficie.
Per ovviare al problema sono stati perciò sviluppati diversi tipi di cateteri vascolari, realizzati con ricoperture antiadesive o trattamenti con sostanze antibatteriche. Probabilmente, con gli opportuni adattamenti tecnologici, anche nel circuito idrico del riunito si potrà in futuro prevedere l'utilizzo di materiali che sfavoriscano l'adesione microbica.
A tal fine vengono attualmente utilizzate come sostanze antibatteriche:
· Argento;
· Clorexidina e Argento-sulfadiazina;
· Antibiotici.
Un altro mezzo di contrasto alla formazione del biofilm è rappresentato dall'impiego di materiali a bassa energia di superficie, il più possibile idrofili, giacche molti batteri sembrano "preferire" superfici idrofobiche.
Ciò ha portato allo studio di nuovi materiali compositi, polimeri rivestiti da pellicole di materiali idrofilici di diverso genere.
Un altro strumento di controllo del rischio di cross-infection derivante dagli spray erogati dal riunito è rappresentato dall'applicazione di filtri o membrane (figura 23) allo scopo di trattenere al loro interno la carica planktonica trasportata con l'acqua ed evitare così di diffonderla con lo spray. Membrane con capacità di ritenzione di 0,22 µm, in grado quindi di intercettare e trattenere i batteri provenienti dall'interno del circuito, sono state applicate sulla parte terminale dei cordoni, a monte dei manipoli. Con questi mezzi di prevenzione, tuttavia, non si svolge alcuna azione nei confronti della retrocontaminazione da paziente né tanto meno sì impedisce la formazione di biofilm o si elimina quello esistente.
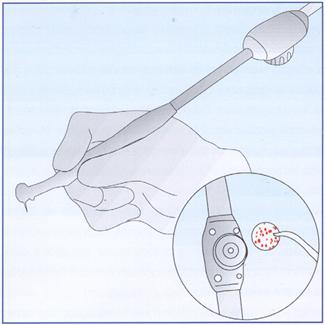
Figura 23: Filtrazione “point-of-use “.
Quanto esposto fin qui spiega perchè l'obiettivo di qualità microbiologica dell'acqua erogata dagli strumenti dentali, fissato dapprima in 200 CFU/ml e più recentemente in 500 UFC/ml, non sia in effetti raggiungibile con i soli mezzi di prevenzione, ma richieda applicazione di sistemi di disinfezione in grado di abbattere significativamente le cariche microbiche ai livelli desiderati (CDC, 2003).
A questo scopo sono state proposte soluzioni secondo diverse strategie di intervento: il trattamento in continuo del liquido utilizzato per lo spray con disinfettanti di basso livello ed il trattamento discontinuo del circuito idrico con un disinfettante ad alto livello, eseguito una tantum o fra un paziente ed il successivo.
Il trattamento in continuo della linea idrica del riunito odontoiatrico è ottenuto mediante la diluizione di un disinfettante nell'acqua destinata agli spray.
In alcune applicazioni il disinfettante è addizionato direttamente all'acqua potabile, nel punto di ingresso al riunito, in altre è introdotto in un serbatoio indipendente assieme al liquido indicato per gli spray, che può essere acqua sterile o acqua distillata (figura 24).
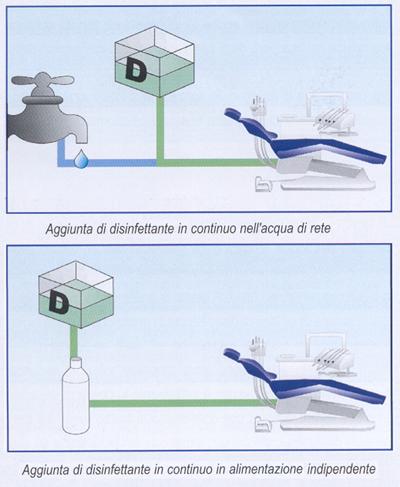
Figura 24: Diluizione di un disinfettante nell'acqua destinata agli spray.
Nel primo caso, il disinfettante dovrebbe controllare allo stesso tempo sia la contaminazione da rete idrica, sia la contaminazione da paziente.
Nel secondo, la contaminazione acquatica è eliminata alla fonte e al disinfettante è affidato il controllo della contaminazione da paziente.
In tutti i casi, l'agente biocida è presente nel liquido degli spray erogati sul campo operatorio, nel cavo orale del paziente, e nebulizzati nell'ambiente circostante.
Per questa ragione deve avere caratteristiche tali da tener conto del contatto diretto con le mucose orali e del contatto permanente con i materiali del circuito idrico.
Vi è inoltre da considerare il rischio di possibili effetti indesiderati soprattutto a carico del personale che vive e opera all'interno dell'ambiente odontoiatrico ove è costantemente esposto all'inalazione degli aerosol prodotti dagli strumenti.
Tra i disinfettanti utilizzati in continuo si annoverano:
· Perossido di idrogeno (H2O2) 0,03/0,1% (0,1/0,3 Volumi): limitata attività battericida con tempi di contatto di 60 minuti, assenza di potere sporicida;
· Cloroderivati (10 ppm): limitato spettro di azione, non sporicida, inattivati da sostanze inorganiche e corrosivi per i metalli;
· Clorexidina 0,2%: limitato spettro di azione, non sporicida, stabile in presenza di materiale organico, limitata tossicità.
Paradossalmente, però, il contatto continuato del disinfettante di basso livello o estremamente diluito porta ad osservare, dopo un certo periodo di tempo, un aumento volumetrico del biofilm associato ad un ulteriore incremento della resistenza dei batteri in forma sessile rispetto a quelli in forma planktonica.
E’ anche possibile applicare un trattamento discontinuo del circuito idrico, quindi al di fuori dall'uso normale, permettendo di affrancarsi dai rischi di contatto del disinfettante con l'operatore o con il paziente, e aprendo la strada all'utilizzo di disinfettanti più efficaci, come i disinfettanti d alto livello.
Alcune industrie, cercando di sfruttare al meglio le potenzialità del metodo discontinuo, impiegano un disinfettante di alto livello, attivo contro batteri, virus, funghi, micobatteri e spore, quindi con uno spettro di azione completo.
L'agente biocida è lo ione Peracetico, generato in soluzione acquosa da una associazione di TAED (Tetra Acetil Etilene Diamina) e Perossidante (Sodio Perborato).
Rapidamente efficace contro spore, virus e batteri, questo disinfettante permette applicazioni in tempi brevi, compatibili con il normale riordino dell'unità operativa dopo ciascun paziente.
Anche la compatibilità ambientale è stata considerata: la soluzione attiva degrada spontaneamente a DAED (Di Acetil Etilene Diamina) e Acido Acetico, sottoprodotti biodegradabili e privi di effetto biocida residuo nelle acque di scarico.
Nella realizzazione del metodo è stata condotta una profonda revisione del progetto di circuito idrico con l'eliminazione di rami morti, l'impiego di componenti idraulici appositamente realizzati in materiali resistenti al contatto con il disinfettante e privi di camere cieche o segmenti esterni alle linee di flusso.
Test di corrosione accelerata hanno valutato la compatibilità disinfettante/circuito ponendo campioni dei metalli costituenti la linea idrica in contatto con soluzioni del disinfettante, rinnovate giornalmente, per 60 giorni a 56°C. Nessuna alterazione apprezzabile è stata registrata sui materiali utilizzati nella realizzazione di questo nuovo metodo, mentre profonde corrosioni si evidenziavano sui metalli impiegati nei circuiti idrici "convenzionali", presi come controllo.
Il processo di disinfezione è applicato dopo ciascun paziente ed avviene secondo una sequenza di fasi (figura 25):
1. espulsione del liquido presente nel circuito con un flusso di aria in pressione;
2. flusso di disinfettante, mediante due distinte fasi di flusso, e pausa di contatto, per tempi complessivi di 2,5 o 10 minuti;
3. espulsione del disinfettante e risciacquo con lo stesso liquido sterile destinato all'alimentazione degli strumenti.
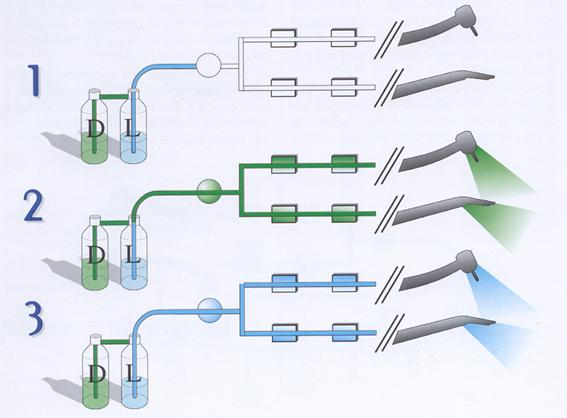
Figura 25: Fasi del metodo denominato “Autosteril” (Castellini S.p.A.).
4.2 Identificazione precoce del paziente infetto
Uno dei fattori che stanno alla base della diffusione delle infezioni tra un soggetto e l’altro è la mancata conoscenza dello stato di infettività di un individuo che può essere un potenziale diffusore dell’infezione.
Questo aspetto assume ancora più importanza se si considerano alcune infezioni per lo più virali, che vengono trasmesse attraverso il sangue o la saliva, come i virus delle epatiti B e C, l’HIV, l’Herpes virus, il virus di Epstein-Barr, ecc.
Per quanto riguarda l’ HIV e l’epatite B e C, una notevole percentuale di soggetti infetti non è a conoscenza del proprio stato e molti di quelli che lo sono non informano l’odontoiatra per diversi motivi (vergogna, scarso rispetto) (Dubois, 1997).
Questi virus possono, in uno studio odontoiatrico, essere trasmessi da un soggetto all’altro attraverso diversi meccanismi rendendo lo studio un luogo particolarmente a rischio per la diffusione di queste infezioni nella popolazione generale.
L’identificazione di un soggetto infetto prima di un intervento è sicuramente utile all’odontoiatra per intensificare le procedure di sicurezza personali, per applicare tutte le metodiche oggi disponibili per prevenire la contaminazione del riunito e per eliminare l’agente infettivo dall’intera attrezzatura al termine dell’intervento.
Per questo motivo la ricerca scientifica e le industrie che operano nel settore si sono attivate per la messa a punto di test rapidi e non invasivi per l’identificazione di pazienti in grado di trasmettere gravi infezioni virali o batteriche attraverso il sangue e/o la saliva.
Per l’identificazione dei pazienti positivi per gli anticorpi anti-HCV è stato recentemente messo a punto un test (anti-HCV rapid test, Standard WHO 1st IRP 75/537) in grado di determinare la presenza di questi anticorpi direttamente nel sangue intero (Montebugnoli, 1999).
Questo metodo è stato adottato da una Ditta di dispositivi medici per odontoiatria la quale ha messo a punto un accessorio, integrato nel riunito odontoiatrico, per la semplice e rapida esecuzione della procedura.
Questo test rapido è basato sul principio di agglutinazione antigene-anticorpo e dà risultati visibili ad occhio nudo in un tempo compreso fra 1 e 5 minuti.
Sono stati eseguiti studi per valutarne le caratteristiche sul sangue intero, sulla saliva e sul fluido crevicolare (Montebugnoli, 1999; Montebugnoli, 2000, a).
I risultati hanno mostrato che il test rapido per gli anti-HCV ha una buona sensibilità e specificità quando utilizzato su sangue, mentre risultati deludenti sono stati ottenuti utilizzando come campione la saliva; tuttavia ha dato buoni risultati sul fluido crevicolare che si è dimostrato un substrato biologico interessante per l’identificazione di soggetti HCV positivi e che nel futuro potrà rappresentare il substrato ideale per sviluppare metodiche diagnostiche rivolte anche ad altri microrganismi patogeni.
Il prototipo per l’esecuzione del test rapido per la ricerca degli anti-HCV è riportato nella figura 26.
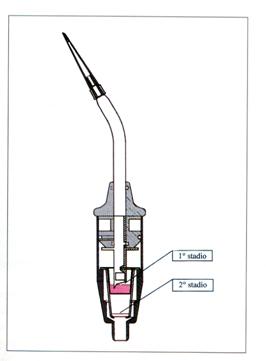
Figura 26: Prototipo per l’esecuzione del test rapido anticorpi anti-HCV.
Nel primo compartimento poche gocce di sangue o di saliva o di sangue misto a saliva, oppure di fluido crevicolare, si miscelano con una soluzione contenente anticorpi umani, ognuno legato ad un enzima rivelatore. Durante il mescolamento avviene il legame tra gli anticorpi umani anti-HCV eventualmente presenti nel sangue o nella saliva e gli anticorpi umani presenti nel reagente.
Dopo una breve attesa con un semplice intervento manuale, si provoca il trasferimento del campione già miscelato nel secondo compartimento dove la miscela giunge su un filtro sulla cui superficie sono immobilizzati in piccole zone di forma circolare, antigeni HCV sintetici e ricombinati.
Durante l’attraversamento del filtro, gli anticorpi anti-HCV eventualmente presenti nel campione e precedentemente legati agli anticorpi umani della soluzione, si legano agli antigeni HCV del filtro formando complessi antigene-anticorpo che rimangono a loro volta intrappolati nel filtro.
La presenza degli immunocomplessi formatisi nel filtro, indicanti la positività per HCV, è rivelata dalla formazione di una evidente macchia circolare di colore rosso.
4.3 Gestione dello strumentario
In ambito odontoiatrico come negli altri settori della medicina, le procedure di disinfezione e sterilizzazione possono assumere un ruolo importante nella prevenzione della trasmissione delle infezioni; perché ciò si realizzi è tuttavia necessario che il loro impiego risponda a specifici requisiti. È necessario scegliere, per ogni singola situazione, la procedura più idonea.
Diverse Associazioni Scientifiche (Centers for Desease Control, Association for Professionals Infection Control and Epidemiology) si sono interessate di questo problema con lo scopo di aggiornare gli operatori sanitari sulle procedure e sui mezzi disponibili fornendo linee guida standardizzate applicabili a tutti i settori della medicina, oppure per alcuni settori specifici come quello odontoiatrico.
Per quanto riguarda gli strumenti odontoiatrici, è ben noto che devono essere puliti e sterilizzati dopo ogni loro utilizzo sul paziente.
L’autoclave (vapore sotto pressione) rappresenta il mezzo migliore per ottenere la sterilizzazione e sicuramente è da preferire ogni qualvolta sia possibile in relazione alle caratteristiche dell’oggetto da sterilizzare.
L’attrezzatura per la sterilizzazione si dovrebbe trovare in una stanza diversa da quella per le cure. Essa consiste in bagni di soluzioni disinfettanti, attrezzature ad ultrasuoni per la pulizia degli strumenti, lavastrumenti, imbustatrice ed autoclave.
In considerazione dell’elevato rischio infettivo connesso all’attività, laddove possibile è sempre preferibile utilizzare articoli monouso, in modo particolare nel trattamento del paziente ad alto rischio.
È inoltre di estrema importanza la disponibilità di una adeguata dotazione ferristica in modo da garantire un turn-over dello strumentario, in relazione alla mole di lavoro da svolgere (Sagliocca, 1990; Bergese, 1994; ADA, 1998; CDC, 1985).
Il trattamento delle attrezzature sanitarie riutilizzabili è uno dei punti chiave nella prevenzione delle infezioni: in ogni situazione deve perciò essere posta in atto la procedura di decontaminazione microbica (detersione-disinfezione-sterilizzazione) atta ad eliminare ogni rischio infettivo (Mele, 2001).
Seguendo la classificazione proposta da Spolding, i dispositivi medici, le apparecchiature e gli altri materiali sanitari si possono classificare in tre categorie (Mele, 2001): articoli critici, semicritici e non critici. In campo odontoiatrico questi possono essere così catalogati:
· articoli critici: comprendono gli strumenti chirurgici o altri materiali che possono penetrare i tessuti molli o l’osso (ad esempio, strumentario chirurgico, aghi, sonde, scollatori, frese per turbina). Se sono contaminati da microrganismi possono facilmente trasmettere infezioni. Pertanto essi devono essere necessariamente sottoposti a sterilizzazione (Mele, 2001);
· articoli semicritici: sono considerati semicritici tutti gli strumenti, oggetti o materiali destinati al contatto con mucose integre (ad esempio, spingipasta, portaimpronta, specchietti). Le mucose integre rappresentano una barriera per le spore, ma sono permeabili a virus ed ai microrganismi in forma vegetativa. È quindi necessario effettuare un trattamento che garantisca la sterilità a meno che la procedura di sterilizzazione a caldo non alteri le proprietà e/o funzioni del dispositivo. Solo in questo caso si può procedere ad una disinfezione ad alto livello (Mele, 2001);
· articoli non critici: sono gli strumenti, oggetti o superfici che entrano in contatto solo con la cute integra oppure che non vengono a contatto con il paziente. In genere questo tipo di articoli non pone importanti problemi di rischio infettivo e quindi il loro trattamento antimicrobico può essere anche la semplice detersione o la disinfezione (Mele, 2001).
È tuttavia necessario evidenziare che in ambito odontoiatrico alcune superfici (es. maniglia della lampada, piano di lavoro) si possono facilmente contaminare (con aerosol prodotto da strumenti rotanti, per contatto con le mani dell’operatore o con attrezzature contaminate); in assenza di adeguati interventi, questa contaminazione microbica può essere trasferita alle mani degli operatori o a materiali sanitari e può così raggiungere il paziente successivo.
Queste superfici devono pertanto essere considerate semicritiche e di conseguenza trattate come tali tra un paziente e l’altro (Mele, 2001).
4.4 Ciclo di trattamento degli strumenti nell’ambulatorio odontoiatrico
Per ottenere un efficace processo di sterilizzazione è necessario seguire le diverse fasi del ciclo di trattamento degli strumenti nell’ambulatorio odontoiatrico (figura 27): decontaminazione, lavaggio, risciacquo, asciugatura, confezionamento e sterilizzazione.
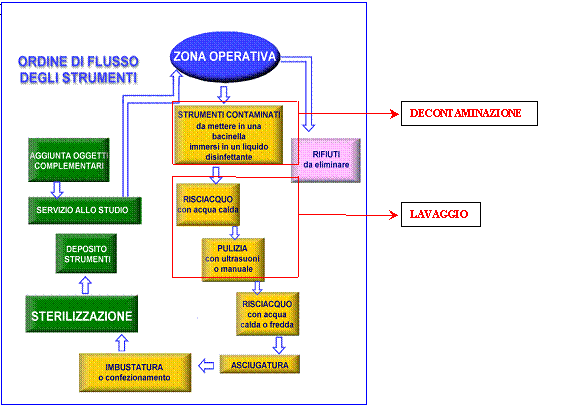
Figura 27: Ciclo di trattamento degli strumenti odontoiatrici.
Decontaminazione
La fase della decontaminazione degli strumenti odontoiatrici, prevista dal Decreto del Ministero della Sanità del 28 settembre 1990 “Norme di protezione del contagio professionale da HIV nelle strutture sanitarie ed assistenziali pubbliche e private” (Decreto Ministero della Sanità 28/9/90, 1990), deve essere applicata su tutti i presidi riutilizzabili, dopo l’uso su pazienti (tranne il caso in cui lo strumento sia utilizzato per la prima volta) (Mele, 2001).
Il suddetto Decreto, nell’Art. 2, prevede che i presidi riutilizzabili, dopo l’uso, debbano essere immersi in un disinfettante chimico di riconosciuta efficacia sull’ HIV, HBV e HCV, prima delle operazioni di smontaggio o pulizia da effettuare come preparazione per la sterilizzazione. L’immersione determina un abbattimento della carica microbica presente sul dispositivo: in tal modo si riduce il rischio infettivo per l’operatore addetto alla manipolazione dello strumentario ed inoltre si evita che il disseccamento del materiale organico renda difficoltose le successive operazioni di pulizia.
Si dovrà porre particolare attenzione che tutto il materiale da decontaminare sia completamente immerso nella soluzione disinfettante.
La scelta del disinfettante deve ricadere su derivati del fenolo o su prodotti che liberano ossigeno attivo; non è raccomandato l’uso di disinfettanti a base di cloro su strumenti in acciaio o metallo in quanto aggressivi; non è altrettanto raccomandato l’uso di disinfettanti a base di glutaraldeide in quanto tossici per il personale, a meno che non vengano rispettate le condizioni di sicurezza per l’operatore.
La scelta del prodotto più idoneo, comunque, andrà fatta avendo cura di controllare alcune caratteristiche molto importanti, quali la corretta marcatura CE supportata da un Ente Notificato e la presenza, in etichetta o nelle istruzioni, delle modalità d’uso quali diluizioni, tempi di contatto, di rinnovo della soluzione e dello spettro di azione (Health Canada, 1998).
Lavaggio
La fase del lavaggio, successiva alla decontaminazione, può essere condotta con varie modalità, a seconda del tipo di attrezzature disponibili.
Gli operatori addetti a tali procedure, devono indossare tutti i necessari dispositivi di protezione individuale, quali guanti di gomma di tipo domestico o guanti anti taglio, mascherine e occhiali o schermi facciali trasparenti per la protezione da eventuali schizzi (Mele, 2001).
Fra le attrezzature utilizzabili per l’esecuzione del lavaggio ricordiamo:
1) Vasca ad ultrasuoni: Gli ultrasuoni permettono una efficace pulizia e disincrostazione dello strumentario in quanto riescono a raggiungere tutti i punti degli strumenti, anche quelli di più difficile accesso, che con la sola pulizia manuale non verrebbero efficacemente raggiunti (figura 28). Una volta terminato il trattamento occorre procedere con la pulizia manuale mediante l’utilizzo di apposite spazzole o scovolini (Health Canada, 1998).

Figura 28: Vasca ad ultrasuoni.
2) Termodisinfettatrice: La lavastrumenti/termodisinfettatrice è una soluzione ottimale per il lavaggio. Questa deve effettuare la disinfezione termica ad almeno 93°C per 10 minuti ed eseguire lo scarico dell’acqua ad ogni fase del ciclo.
Il lavaggio automatico con termodisinfettatrice presenta numerosi vantaggi rispetto al lavaggio manuale quali il risparmio di tempo e di personale, l’elevata protezione del personale dal rischio infettivo, la standardizzazione del trattamento e la possibilità di validazione del processo (Health Canada, 1998).
Risciacquo e asciugatura
La fase di asciugatura deve essere preceduta da un accurato risciacquo per eliminare ogni traccia di detergente o disinfettante, che potrebbe provocare fenomeni di corrosione o alterazione delle superfici degli strumenti.
L’asciugatura può essere effettuata con teli puliti o panni monouso, non necessariamente sterili (Health Canada, 1998).
Confezionamento
Si esegue dopo l’asciugatura ed ha essenzialmente la funzione di mantenere la sterilità del materiale, ottenuta dopo autoclavaggio, fino al momento del suo utilizzo.
Generalmente il confezionamento dello strumentario avviene o per singoli strumenti o dispositivi, oppure attraverso la composizione di set per procedure specifiche.
In ambito odontoiatrico i materiali preferiti per il confezionamento sono le sterilbuste carta-polimero (figura 29) e la carta medicale.

Figura 29: Confezionamento con sterilbusta.
Sterilizzazione
Dopo l’imbustamento gli strumenti vengono sottoposti a sterilizzazione, trattata di seguito (4.6).
4.5 Utilizzo di materiale monouso
L’adozione di materiale monouso, ove è possibile, permette di risolvere a monte molti aspetti della prevenzione del rischio infettivo ed è pertanto largamente raccomandata soprattutto per articoli critici (es. aghi) o quando il trattamento di decontaminazione risulterebbe complesso e dispendioso (es. aspirasaliva). È perciò consigliabile introdurre, ove possibile, l’impiego di questi materiali che, secondo la normativa vigente, devono sempre essere utilizzati una volta sola (Mele, 2001).
4.6 Procedure antimicrobiche e Sterilizzazione
L’obiettivo delle procedure antimicrobiche (sterilizzazione, disinfezione e detersione) è quello di eliminare o, secondo i casi, ridurre a livelli di sicurezza la carica di contaminanti microbici sugli strumenti o sulle superfici. Nelle differenti situazioni, una scelta razionale dell’intervento antimicrobico presuppone la conoscenza dell’efficacia, delle caratteristiche principali e delle indicazioni dei diversi metodi (Sagliocca, 1990; Barbera, 1992; Mele, 2001).
Detersione
Con tale procedura si ottiene la rimozione e l’allontanamento di materiale organico e di alcuni microrganismi dalle superfici. Deve essere ritenuto un intervento preliminare obbligatorio prima della disinfezione o della sterilizzazione mentre è sufficiente di per sé in casi di rischio infettivo limitato, come ad esempio il lavaggio abituale dei pavimenti (Sagliocca, 1990; Barbera, 1992; Mele, 2001).
Le varie fasi della procedura possono essere così articolate:
- lavaggio con acqua calda;
- immersione in recipienti contenenti prodotti detergenti-disinfettanti quali clorexidina, derivati dell’ammonio quaternario, iodofori ecc., utili per lo scioglimento e l’allontanamento di materiale organico; tali prodotti devono essere utilizzati secondo tempi e concentrazioni opportune e rinnovati entro brevi intervalli;
- uso dello spazzolino;
- risciacquo e asciugatura con asciugamano monouso o ad aria compressa (Sagliocca, 1990; Barbera, 1992).
Il Ministero della Sanità (D.M. 28 settembre 1990) ha stabilito che prima della detersione i materiali contaminati vengano sottoposti ad un intervanto di decontaminazione da effettuare con disinfettanti. Tale procedura, come già detto, ha lo scopo di abbattere la carica microbica per ridurre il rischio infettivo per gli operatori addetti alla detersione (Decreto Ministero della Sanità 28/9/90, 1990).
Disinfezione
La disinfezione ha come obiettivo la distruzione dei microrganismi patogeni. Nella pratica il risultato di un processo di disinfezione può variare entro limiti anche molto ampi in funzione dello spettro d’azione del disinfettante scelto, delle modalità del suo impiego e della tipologia dei microrganismi presenti. La sensibilità che questi presentano nei confronti dei disinfettanti è una caratteristica legata alle differenti specie e risulta massima per alcuni batteri in forma vegetativa o alcuni virus e minima per le spore batteriche. I disinfettanti possono avere attività antimicrobica di differente entità ed il loro livello di attività può essere distinto in alto, intermedio e basso (Mele, 2001) (tabella 4).
|
DISINFETTANTI |
CONCENTRAZIONE D’USO |
LIVELLO DI ATTIVITA’ |
|
Aldeide glutarica |
2% |
Alto |
|
Acido peracetico |
<1% |
Alto |
|
Perossido di idrogeno |
6% |
Alto |
|
Ortoftalaldeide |
0,55% |
Alto |
|
Cloroderivati |
0,1-0,5% Cloro libero (1.000-5.000 ppm) |
Intermedio |
|
Iodofori |
iodio libero (300-500 ppm) |
Intermedio |
|
Alcool etilico e isopropilico |
70-90% |
Intermedio |
|
Derivati fenolici |
0,5-3% (secondo prodotto) |
Intermedio/Basso |
|
Cloroderivati |
100-500 ppm |
Basso |
|
Composti di ammonio quaternario |
0,1-0,2% secondo prodotto |
Basso |
Tabella 4: Principali disinfettanti, concentrazione d’uso e livello di attività.
I disinfettanti ad alto livello di attività coprono tutto lo spettro microbico ad eccezione delle spore; quelli con basso livello sono efficaci solo sui batteri in forma vegetativa e su virus con involucro lipidico. Tra i disinfettanti di livello intermedio sono classificati prodotti con profili di attività non sovrapponibili e dei quali è necessario valutare singolarmente le proprietà antimicrobiche.
E’ importante precisare che il livello di attività dei disinfettanti in tabella indicato, viene raggiunto solo in presenza di un impiego corretto (concentrazioni e tempo di esposizione raccomandati, precedente detersione, ecc).
Il disinfettante di alto livello sino ad ora più consigliato è l’aldeide glutarica al 2 %. Il perossido di idrogeno al 6 % non trova impiego in ambito clinico perché di difficile manipolazione (caustico). Negli ultimi tempi sono comparsi sul mercato prodotti a base di acido peracetico, che potranno in futuro coprire una parte delle esigenze per interventi di alto livello, e ortoftalaldeide, che presenta un interessante profilo di elevata attività, caratteristiche di maneggevolezza migliori di quelle della aldeide glutarica ma un elevato costo.
I disinfettanti a basso livello di attività non devono essere usati per la disinfezione dello strumentario. In questa classe sono compresi, oltre ai sali di ammonio quaternario anche i cloroderivati a bassa concentrazione e la clorexidina, che ha suo specifico ruolo per l’impiego sull’uomo (antisepsi) ma che presenta scarso interesse per l’uso in disinfezione.
L’uso dell’alcool etilico è sconsigliato per la mancanza di efficacia sul virus dell’epatite B e, più in generale, perché la sua volatilità non permette un tempo di contatto sufficiente per garantire una adeguata disinfezione.
Il risultato di un processo di disinfezione non dipende solo dal disinfettante impiegato, ma può essere condizionato da numerosi fattori, in particolare da:
· presenza di residui organici: è, quindi, essenziale che una accurata detersione preceda gli interventi di disinfezione;
· concentrazione d’uso: l’impiego di disinfettanti a concentrazioni inferiori a quelle raccomandate invalida l’efficacia del processo; concentrazioni superiori spesso non migliorano l’efficacia ma fanno comparire effetti indesiderati. Nella pratica la concentrazione d’uso può rappresentare un problema sia quando il disinfettante è da preparare al momento dell’uso (da ciò la necessità di adottare procedure standardizzate e corrette) sia quando esso viene riutilizzato (rischio di diluizione se lo strumento non viene asciugato dopo la detersione);
· tempo di contatto: il tempo di esposizione raccomandato è quello che si è dimostrato efficace per assicurare i migliori risultati. Abbreviare il tempo d’azione può comportare un effetto non completo mentre allungarlo eccessivamente può determinare danni ai materiali;
· fenomeni di inattivazione del disinfettante: (per presenza di sapone, per la durezza dell’acqua, l’esposizione alla luce, ecc.);
· tempo di validità del disinfettante: il prodotto pronto per l’uso fornito da un produttore ha indicato in etichetta il suo tempo di validità, che deve essere rispettato. Più complesso è il problema quando l’utilizzatore provvede a diluire il disinfettante: infatti con il passare del tempo l’attività del disinfettante diluito diminuisce, più o meno rapidamente secondo il prodotto. È quindi fondamentale documentarsi sul tempo di validità dei disinfettanti diluiti sia per avere in uso preparati efficaci sia perché, soprattutto in alcuni casi, questo fenomeno comporta un aumentato rischio di inquinamento;
· tipo di contenitore utilizzato e modalità della sua bonifica: è preferibile l’uso di contenitori monouso di piccolo volume. Ove ciò non sia possibile, deve essere previsto un accurato lavaggio e, possibilmente, la sterilizzazione al calore dei contenitori prima del loro riempimento. È assolutamente da evitare il “rabbocco” di contenitori che non siano stati bonificati (Mele, 2001).
Sterilizzazione
Per sterilizzazione si intende la distruzione di tutti i microrganismi patogeni e non patogeni, comprese le spore, presenti su un determinato substrato.
Rappresenta l’intervento di “prima scelta” da preferire in tutti i casi in cui possa essere applicato (Mele, 2001).
La sterilizzazione può essere realizzata con mezzi fisici o fisico-chimici.
L’efficacia della sterilizzazione con mezzi fisici è garantita a condizione che:
- il ciclo di sterilizzazione sia sottoposto a convalida;
- il ciclo di sterilizzazione non venga interrotto: in caso di interruzione è necessario ricominciare dall’inizio;
- le apparecchiature siano utilizzate correttamente e vengano sottoposte a manutenzione di routine (Mele, 2001).
La sterilizzazione con mezzi fisici può essere realizzata con diverse apparecchiature e sicuramente quella da preferire è l’autoclave (figura 30) che utilizza vapore sotto pressione e rappresenta il sistema più efficace a condizione che la gestione avvenga in maniera corretta (Sagliocca, 1990).


Figura 30: Alcuni tipi di autoclave utilizzate negli studi odontoiatrici.
Questo metodo garantisce la distruzione anche delle spore in tempi brevi ed è vantaggioso perché il vapore cede rapidamente grandi quantità di calore, per condensazione, all’oggetto da sterilizzare (Mele, 2001).
Il suo utilizzo non è idoneo nel caso di materiali non termoresistenti.
Il risultato della sterilizzazione è frutto della combinazione di parametri specifici tra loro rigorosamente correlati: tempo, temperatura, pressione.
La variazione anche di un solo di questi influisce sull’esito della sterilizzazione.
I valori vengono scelti a seconda del tipo di materiale da trattare: 7 minuti a temperatura 134°C a pressione 2.1 bar per ferri chirurgici, teleria, vetreria temperata; 15 minuti a temperatura 121°C a pressione 1.1 bar per gomma e plastica (Medical Devices Agency, 1997).
Oltre a verificare routinariamente l’efficacia della sterilizzazione attraverso l’uso di appositi nastri di viraggio, è necessario un monitoraggio con l’uso di indicatori biologici. Infatti i nastri indicatori consentono di stabilire se è stata raggiunta una determinata temperatura ma non offrono garanzie assolute in quanto non indicano se tale temperatura è stata mantenuta fino alla completa sterilizzazione del materiale. Per questo motivo i mezzi di controllo più sicuri sono i test con indicatori biologici contenenti spore che sono in grado di monitorizzare simultaneamente tutti i parametri dell’autoclave: temperatura, pressione, tempo di esposizione (Palenik, 1991).
Il monitoraggio della sterilizzazione con questi test dovrebbe essere eseguito con cadenze settimanali (ADA, 1996; Miller C.H., 1993; Miller C.H., 1996). Tra le spore batteriche sono raccomandate le spore di Bacillus stearothermophilis (ADA, 1992; Indian Public Law, 1992) fornite in diverse confezione; un semplice procedimento consiste in ampolle di vetro ripiene di spore, collocate all’interno della camera e rimosse dopo il ciclo di sterilizzazione per essere incubate a 56°C per 48 ore (Miller C.H., 1994).
Purtroppo, durante la normale pratica quotidiana, tali procedure non vengono sempre prese tutte in considerazione da parte dell’odontoiatra, con il risultato che la sterilizzazione mediante autoclave può risultare a volte una metodica non efficace. A riprova di questo, alcune ricerche condotte negli Stati Uniti (Simonsen, 1979; Palenik, 1986), in Norvegia (Skaug, 1983) e in Germania (Engelhardt, 1976) hanno dimostrato che una cospicua percentuale di autoclavi utilizzate negli studi privati aveva perso efficacia nella sterilizzazione. In particolare sono stati riportati fallimenti pari al 15-33% delle autoclavi selezionate negli USA, al 23% in Norvegia e al 12% in Germania.
Studi più recenti hanno rilevato che in Canada circa il 4% delle autoclavi utilizzate negli studi odontoiatrici non svolgeva un ciclo di sterilizzazione efficace (Mc Erlane, 1992), così nel 3-7% di quelle in Danimarca (Scheutz, 1988) e nel 2% in UK (Burke, 1998).
L’autoclave a vapore è soggetta a normative specifiche riguardanti il suo impiego e la sua manutenzione.
La sterilizzazione con stufa a secco è ormai praticamente inutilizzata negli studi odontoiatrici in quanto non garantisce la stessa efficacia e sicurezza dell’autoclave.
Essa prevede :
- decontaminazione e detersione del materiale;
- preriscaldamento fino alla temperatura di 160°C;
- durata del ciclo di 120 minuti a temperatura di 160°C;
- conservazione in idonee cassette (Sagliocca, 1990).
L’impiego della sterilizzatrice a granuli di quarzo, la cui efficacia oggi è messa in discussione, è limitata alla sterilizzazione di emergenza di piccolo strumentario; a parte l’efficacia, l’uso è limitato a causa dell’alta temperatura che deve essere raggiunta (che danneggia i rivestimenti plastici di strumenti metallici) e per le ridotte dimensioni della apparecchiatura, che permette la sterilizzazione solo di strumenti molto piccoli (Rutala, 1999).
Gli apparecchi a microonde, di recente fabbricazione, permettono la sterilizzazione di strumentari e attrezzature diverse, manipoli, turbine, pinze, ecc. in tempi di 90-180 secondi, senza l’intervento delle alte temperature (Sagliocca, 1990; Rutala, 1999).
I mezzi fisico-chimici per la sterilizzazione, come l’autoclave ad ossido di etilene, l’autoclave a formaldeide e l’autoclave a gas-plasma hanno avuto scarsissimo utilizzo in campo odontoiatrico per diversi motivi soprattutto per la difficoltà pratica nel loro utilizzo come la necessità di una adeguata ventilazione dell’ambiente.
Per quanto concerne i mezzi chimici utilizzati quando gli strumenti da sterilizzare non sono termoresistenti, questi garantiscono un alto livello di disinfezione che si avvicina ai risultati ottenuti con la sterilizzazione purché vengano rispettati rigorosamente alcuni parametri quali la concentrazione, il pH e soprattutto i tempi di contatto. Infatti, per esempio, la glutaraldeide (2%, pH8) garantisce la distruzione delle spore eventualmente presenti nel substrato, purché il contatto con il disinfettante sia mantenuto per tempi lunghi (5-10 ore) (Burke, 1998).
La glutaraldeide, in soluzione al 2%, dopo 10 minuti è in grado di inattivare le forme vegetative dei batteri Gram- e Gram+; sono necessari 30 minuti di contatto per inattivare il virus dell’epatite B (HBV) ed il virus dell’immunodeficienza acquisita (HIV) e circa 60 minuti per l’inattivazione del Mycobacterium tubercolosis. Per inattivare le spore occorrono 10 ore di contatto (questo tempo dà la certezza di eliminare anche le spore più resistenti) (Pitzurra, 1999; Martin, 1994).
L’immersione in soluzioni di aldeide glutarica al 2%, però, anche se ampiamente diffusa, non offre le stesse garanzie di sicurezza della sterilizzazione fisica con calore umido (autoclave) (Mele, 2001).
Infatti:
- è difficile essere certi del reale contatto di tutto l’oggetto (cavità, ecc.) con il prodotto chimico;
- per ottenere la sterilizzazione (ossia l’eliminazione delle spore) gli strumenti devono essere immersi nel disinfettante per almeno 10 ore;
- dopo il trattamento gli oggetti devono essere risciacquati per allontanare le tracce del disinfettante e devono essere fatti asciugare prima di essere riposti (questa metodica non consente, quindi di ottenere oggetti asciutti, impacchettati, sterili);
- non esistono indicatori di processo (al contrario di quanto si verifica per la sterilizzazione in autoclave): è quindi impossibile verificare l’efficacia del processo di sterilizzazione;
- infine, l’uso della glutaraldeide impone l’utilizzo da parte del personale di dispositivi di protezione individuale e di una cappa aspirante (secondo il DL 626/94) (Mele, 2001).
4.7 Disinfezione dei materiali da impronta
Questa manovra purtroppo viene spesso trascurata. I microrganismi sono in grado di aderire ai materiali da impronta ed è stato visto che la semplice manovra di lavaggio consente di abbattere la carica batterica solo fino ad un certo livello. La disinfezione delle impronte, per immersione o mediante spray, deve, quindi, diventare una pratica abitudinaria negli studi professionali in modo tale da poter interrompere una delle potenziali vie di trasmissione d’infezioni crociate che possono colpire i pazienti, gli odontotecnici ed il personale di studio, odontoiatra compreso (Montagna, 1995).
Il problema della disinfezione dei materiali da impronta trova le sue origini intorno agli anni ’80. Già allora si aveva la consapevolezza che i materiali da impronta subivano la contaminazione microbica per contatto con l’ambiente orale, con le conseguenti possibilità d’infezioni crociate anche per gli operatori del laboratorio odontotecnico (Villania, 1995).
L’attenzione nei riguardi di questo problema, oggi appare indispensabile in relazione sia alle patologie virali (virus dell’HIV e delle epatiti) sia per la recrudescenza di alcune patologie come la tubercolosi (Procopio, 1996).
Nel 1990 il Ministero della Sanità ha emesso un decreto (28/09/90), pubblicato sulla G.U. n. 235/90, con le misure di prevenzione che devono essere adottate sia nelle strutture pubbliche sia in quelle private, al fine di migliorare il controllo delle infezioni durante l’attività ambulatoriale (Montagna, 1995). Se l’igiene ambientale dello studio odontoiatrico e la sterilizzazione dello strumentario sono stati due aspetti ampiamente considerati ed approfonditi, lo stesso non si può dire della disinfezione dei materiali da impronta. La difficoltà nel realizzare questo punto nasce dal fatto che la pulizia e la disinfezione delle impronte devono avvenire tenendo presente sia l’efficacia microbiologica del disinfettante, sia la stabilità dimensionale del materiale da impronta, sia la compatibilità dei gessi con il materiale disinfettante.
I materiali da impronta oggi utilizzati sono gli alginati, i siliconi, i polieteri e gli idrocolloidi. Questi materiali proprio per le loro caratteristiche intrinseche non possono essere sterilizzati con mezzi fisici (autoclave e stufa a secco) in quanto subirebbero delle alterazioni tali da compromettere la qualità dell’impronta; di conseguenza la disinfezione deve essere realizzata per mezzo di sostanze chimiche ad azione germicida.
La letteratura sulla compatibilità di tali sostanze chimiche con i materiali da impronta più comunemente usati, mostra una certa discordanza di risultati, ciò nasce dal fatto che le ricerche il più delle volte vengono eseguite senza standardizzare le metodiche (Montagna, 1995; Procopio, 1996; Villania, 1995). La disinfezione dell’impronta deve essere in ogni caso preceduta dal lavaggio subito dopo aver tolto il portaimpronta dalla bocca, che si ottiene con abbondante getto d’acqua in modo tale da eliminare completamente sia le macchie di sangue sia la saliva. A questo punto è possibile eseguire la disinfezione dell’impronta con la sostanza che è più compatibile rispetto al materiale prescelto; terminata la disinfezione, l’impronta va nuovamente lavata al fine di allontanare i residui di disinfettante che rimanendo adesi al materiale potrebbero interferire con la presa del gesso (Montagna, 1995). Le sostanze più utilizzate per la disinfezione delle impronte sono il Niclor5 (ipoclorito di sodio), il MD520, la Cetylcide (aldeidi) e il Sacti-med spray (etanolo). Per quanto riguarda la compatibilità tra materiale da impronta e disinfettante, l’American Dental Association riferisce che bisogna attenersi ai metodi di disinfezione riportati in tabella 5.
|
Tipo di materiale |
Metodo di disinfezione |
Disinfettanti |
|
ALGINATI IDROCOLLOIDI REVERSIBILI |
Nebulizzazione o immersione rapida(10”) e risciacquo dopo 30’ |
Composti del cloro 0,5-1% |
|
SILICONI POLISOFURI |
Immersione per 30” |
Composti del cloro 0,5-1% glutaraldeide al 2% |
|
POLIETERI |
Nebulizzazione o immersione rapida per 10” |
Composti del cloro 0,5-1% |
Tabella 5: Compatibilità tra materiali di impronta e disinfettanti.
Da quanto finora esposto risulta che oggi è possibile mettere in atto una serie di meccanismi idonei a prevenire la diffusione di infezioni crociate tra lo studio dentistico ed il laboratorio odontotecnico.
È certamente compito dell’odontoiatra, grazie alle sue conoscenze medico-sanitarie, alle attrezzature specifiche ed alla disponibilità di personale qualificato, evitare in modo assoluto di inviare all’odontotecnico materiale contaminato (Storer, 1981).
4.8 Protezione di operatori e Precauzioni universali
Protezione dell’ operatore
Poiché non è possibile individuare (attraverso la storia clinica, l’esame fisico o test di laboratorio) tutti i pazienti portatori di malattie infettive trasmissibili, il Centers for Disease Control (CDC) ha introdotto il concetto di Precauzioni Universali.
Precauzioni Universali
Con questo termine si indica il metodo di controllo delle infezioni in base al quale il sangue umano e certi fluidi (in campo odontoiatrico la saliva) devono sempre essere trattati come se fossero potenzialmente infettanti in quanto possono veicolare HBV, HCV, HIV o altri patogeni trasmissibili (Mele, 2001).
Così come tutti i pazienti devono essere considerati a rischio, allo stesso modo da un punto di vista operativo, tutte le manovre devono essere ritenute a rischio anche quelle non invasive, in quanto le modalità di trasmissione delle infezioni sono diverse e possono avvenire attraverso il sangue, la saliva, il fluido gengivale, l’aerosol.
Le manovre di protezione e di prevenzione da parte del dentista, iniziano con il trattamento e la pulizia delle mani, operazioni che devono essere sempre effettuate tra un paziente e l’altro.
Il comune sapone e l’acqua sono di per sé sufficienti a rimuovere i microrganismi acquisiti occasionalmente nel contatto diretto o indiretto col paziente; per una disinfezione più accurata all’operazione precedente può essere fatto seguire il trattamento delle mani con sali di ammonio quaternario, iodofori, alcool al 70% o clorexidina allo 0,5%.
È bene ricordare che prima di lavarsi le mani e prima di indossare i guanti bisogna provvedere all’allontanamento di tutti quegli oggetti personali (anelli e braccialetti) che costituiscono un sito di contaminazione non detergibile e possono determinare la foratura dei guanti (Mele, 2001).
Dopo questa prima operazione, si esegue la protezione dell’operatore tramite barriere protettive (figura 31) al fine di impedire il passaggio di microrganismi dal proprio corpo verso l’ambiente e viceversa.
I componenti che permettono di ottenere tale effetto barriera possono essere distinti in:
- Abbigliamento propriamente detto che include camici, pantaloni, cappellini e copriscarpe;
- Accessori dell’abbigliamento quali guanti, mascherine, occhiali, maschere facciali, tutti rigorosamente monouso o sterilizzabili;
- Calzature (Maggiore, 1996; ADA, 1998; CDC, 1985).
I guanti devono essere cambiati tra paziente e paziente ed ogni qual volta si presentino lesionati.
È importante ricordare che i guanti sono monouso e pertanto non devono essere mai lavati (si alterano o si possono rompere), ma sostituiti sistematicamente.
I camici debbono essere puliti e cambiati almeno giornalmente; nel caso di schizzi o grossolane contaminazioni con sangue si raccomanda di indossare un nuovo camice.
Quando possibile è preferibile ricorrere all’utilizzo di camici monouso.
Le mascherine prevengono il contatto con aerosol di goccioline di saliva o sangue: devono essere indossate nell’assistenza di ogni paziente ed essere sostituite tra paziente e paziente.
L’uso di occhiali di protezione o maschere trasparenti o visiere è altamente raccomandato nel corso di manovre che possono provocare spruzzi di sangue o pus.
Ciò è particolarmente frequente quando si usano le turbine.
Gli occhiali e la mascherina, a meno che non siano a chiusura ermetica, non proteggono le mucose dall’aerosol generato dalla turbina (Montagna, 1995; Mele, 2001).


Figura 31: Alcune barriere protettive utilizzate dagli odontoiatri.
Oltre all’uso delle barriere protettive suddette è anche raccomandato, quando possibile, l’uso di dighe che oltre a proteggere l’operatore, consentono di mantenere un campo operatorio il più possibile asciutto da contaminazione salivare (Mele, 2001).
4.9 Protezione e ruolo del personale ausiliario
L’assistente alla poltrona, dopo l’odontoiatra, è colui che maggiormente viene a contatto con il paziente e quindi deve sottoporsi alle misure di prevenzione e protezione precedentemente esposte per l’odontoiatra.
Il ruolo dell’assistente non è soltanto quello di collaborare alle fasi operative del trattamento odontoiatrico ma è anche quello di mettere in atto tutte le misure che impediscono il propagarsi di infezioni crociate, sia attraverso la preparazione dell’ambiente-studio prima della terapia, sia mediante il riordino ed il riassetto della poltrona e la sterilizzazione degli strumenti.
Per quanto riguarda il primo punto è utile ricordare che prima di iniziare una terapia bisogna:
- Proteggere con fogli di plastica le aree di difficile disinfezione (maniglie e faretra).
- Preparare il vassoio e lo strumentario mantenendoli coperti fino all’inizio dell’intervento.
- Predisporre il materiale monouso.
- Montare i manipoli precedentemente sterilizzati.
L’altro compito importante dell’assistente è quello di effettuare, alla fine della terapia, una serie di procedure quali la decontaminazione biologica di tutte le superfici potenzialmente interessate (detersione e disinfezione con germicida) nonché la detersione, l’imbustamento e la sterilizzazione di tutti gli strumenti utilizzati.
Anche tutto il materiale che dallo studio viene inviato al laboratorio odontotecnico deve subire la stessa accurata disinfezione riservata a tutto il resto dello strumentario (Maggiore, 1996; ADA, 1998; CDC, 1985; Rongione, 1987).
Un intervento preventivo di fondamentale importanza è rappresentato dall’adozione di una scheda clinica che contenga anche notizie anamnestiche, da riempire alla prima visita a da aggiornare ad ogni visita successiva.
Particolare importanza assume l’individuazione di eventuali fattori di rischio, quali ad esempio la positività per l’ HBsAg o la tossicodipendenza, ai fini della corretta gestione del singolo paziente.
È comunque necessario considerare ogni paziente come potenzialmente ad alto rischio infettivo, mantenendo un livello di attenzione costante e attuando sistematicamente tutte le norme preventive:
- qualora un paziente venga riconosciuto ad alto rischio infettivo, prenotare la visita del paziente a fine giornata di lavoro;
- rivestire la poltrona, il braccio di lavoro, le lampade, la tastiera dei comandi ed eventuali altre attrezzature con fogli monouso di polietilene;
- predisporre il contenitore idoneo per la raccolta dei rifiuti ospedalieri e il contenitore per strumenti taglienti;
- evitare di toccare con i guanti contaminati le varie suppellettili;
- proteggere i piani di lavoro con telino monouso, da cambiare dopo ciascun paziente;
- predisporre gli strumenti di lavoro su apposito vassoio al fine di evitare di aprire cassettiere e contaminare così suppellettili e strumentario da utilizzare su pazienti successivi;
- dopo l’uso procedere all’autoclavaggio dei manipoli, turbine, cannule di aspirazione, ablatori per tartaro; è tuttavia consigliabile utilizzare frese per turbina di tipo monouso o comunque strumenti autoclavabili;
- procedere alla disinfezione delle superfici, della sputacchiera, dei tubi di drenaggio e degli aspiratori con idoneo disinfettante dopo la cura di ciascun paziente.
Va comunque ribadita la necessità di procedere alla detersione delle superfici e alla disinfezione dei tubi di drenaggio alla fine di ogni turno di lavoro giornaliero (Sagliocca, 1990; Rongione, 1987; Regione Toscana, 1992).
4.11 Altre misure di prevenzione
Come sottolineato precedentemente, il rischio di infezione per il personale odontoiatrico è consistente.
Il corretto uso di misure di barriera contribuisce a diminuire il rischio, ma è necessario adottare altre precauzioni specifiche (Mele, 2001) come la vaccinazione per HBV.
Il vaccino contro l’epatite B infatti è uno strumento preventivo sicuro ed efficace.
Vi è quindi una indicazione assoluta alla vaccinazione del personale sanitario che lavora in ambito odontoiatrico (Mele, 2001; ISS, 2000).
Importante è anche una corretta gestione di aghi ed altri strumenti taglienti, infatti la maggior parte delle punture accidentali si verificano nel tentativo di reincappucciare l’ago dopo l’uso. Questa manovra, così come quella di disconnettere manualmente gli aghi dalla siringa deve essere assolutamente evitata (Mele, 2001; Health Canada, 1998).
Non di scarsa importanza è il corretto smaltimento dei rifiuti in appositi contenitori rigidi, provvisti all’interno di sacco in polietilene.
Aghi e taglienti vanno smaltiti negli agobox (Mele, 2001).
Infine in caso di accidentale esposizione a materiale biologico potenzialmente contaminato da HBV, HCV, HIV occorre adottare immediatamente misure preventive che prevedano la valutazione dell’applicazione di una opportuna profilassi post-esposizione ed un follow up sierologico (Mele, 2001).
4.12 Controllo microbiologico ambientale in ambulatorio odontoiatrico
Un altro importante aspetto da valutare riguardo la trasmissione di infezioni crociate insorge dall’avvicendamento di un numero elevato di persone nello studio, ma soprattutto dall’uso di strumenti rotanti ad alta velocità su tessuti spesso infetti, uso che porta alla formazione di aerosol microbici che dalla bocca del paziente si proiettano nell’ambiente.
Queste situazioni favoriscono l’aumento quantitativo e qualitativo dei microrganismi che contaminano l’aria con conseguente ricaduta su tutte le superfici.
Gli spray d’acqua utilizzati per il raffreddamento del dente quando viene sottoposto all’azione del turbotrapano, oppure il getto d’aria compressa immesso nella cavità buccale o nelle cavità cariose, determinano getti di nebulizzazione che fuoriescono dalla bocca del paziente e, come è stato chiaramente documentato grazie a particolari tecniche fotografiche, si diffondono nell’ambiente, investendo direttamente o marginalmente sia il dentista che l’assistente; le particelle più grandi ricadono in basso e si depositano sulla mano dell’operatore, sul viso del paziente e nell’ambiente circostante.
L’aria può essere pertanto veicolo di diffusione ambientale di microrganismi e può svolgere un ruolo determinante negli episodi di infezione post-intervento.
La natura dei germi contenuti nell’aerosol non è solo saprofita, ma può anche essere patogena e/o patogena opportunista.
Il monitoraggio della contaminazione microbica aerea è stato effettuato prevalentemente nelle sale operatorie (Pitzurra, 1993), mentre meno frequenti sono state le indagini in ambiente odontoiatrico (Gasparini, 1995; Fausti, 1996; Kumer, 1994).
La ricerca della contaminazione viene di solito effettuata mediante due differenti metodiche:
1. utilizzando il campionamento attivo con l’apparecchio SAS (Surface Air System);
2. tramite campionamento passivo con piastre di sedimentazione per la rilevazione dell’Indice Microbico Aria (IMA) (Pitzurra, 1993).
Esistono anche campionatori muniti di sistemi per il frazionamento secondo la granulometria degli aerosol microbici (Jensen, 1995).
La contaminazione microbica aerea, in assenza di idonei sistemi di decontaminazione, permane per lunghi periodi e al fine di limitare il livello di tale contaminazione sono state individuate metodiche utili per ridurre la formazione di aerosol o per abbattere i microrganismi aerodispersi (Legnani, 1993).
La contaminazione delle superfici degli studi odontoiatrici, quale indice dell’attenzione alle norme preventive e di una potenziale trasmissione di agenti patogeni, è stata rilevata da vari Autori anche mediante tecniche sofisticate, ad esempio la PCR per la rilevazione di particelle di materiale genetico di virus dell’epatite (Piazza, 1987; Piazza, 1995, a).
Il campionamento viene effettuato di solito mediante piastre di contatto Rodac e più recentemente è stata applicata una metodica che utilizza membrane filtranti (Pitzurra, 1997).
In questo monitoraggio, interessanti potenzialità di applicazione mostrano alcune tecniche rapide per la valutazione della contaminazione microbica totale, mediante prove di bioluminescenza (Schram, 1989; Girotti, 1996).
In una indagine (Carducci, 1993) eseguita in Italia per valutare la contaminazione microbica nell’ambulatorio odontoiatrico privato, utilizzando il campionatore Surface Air System (SAS) per l’Indice Microbico Aria (IMA) e prelievi su superfici con apposite piastre per contatto, è emerso che i valori di carica microbica erano al di sotto di quelli riscontrati in lavori analoghi eseguiti in strutture pubbliche. Tuttavia il marcato aumento della contaminazione già dopo due ore di attività indicava che l’ambiente era scarsamente idoneo per mantenere la carica microbica a bassi livelli. Uno studio di Signoretto (Signoretto, 1994) ha messo in evidenza il ruolo esercitato dalle microgocce dell’aerosol che possono derivare dagli atti respiratori o dalla fonazione umana, ma soprattutto, dall’uso di strumenti rotanti ad alta velocità quali micromotori, turbine, ablatori di tartaro, pulitori al carbonato.
Nella tabella 6 sono elencati i principali microrganismi patogeni che possono essere trasmessi con aerosol.
La tabella 7 mostra, invece, le caratteristiche fisiche di un aerosol che si forma a partire da strumenti rotanti ad alta velocità.
|
Virus: - Orthomixovirus (influenza) - Rhinovirus (comune raffreddore) - Adenovirus - Paramixovirus (morbillo e parotite) - Togavirus (rosolia) - Herpesvirus (simplex, varicella, zoster, Epstein-Barr) |
|
Batteri: - Streptococcus mutans - Streptococcus pneumoniae - Streptococcus pyogenes - Haemophylus spp - Bordetella pertussis - Mycobacterium tubercolosis |
Tabella 6: Microrganismi che possono essere trasmessi attraverso aerosol.
|
Parametri |
Gocce |
Particelle |
|
Dimensioni |
>100 μm |
< 100 μm |
|
Tempo di sospensione in aria |
Minuti |
Ore (max. 24h) |
|
Penetrazione nell’apparato respiratorio |
Poco probabile |
Possibile |
|
Modalità di trasmissione dell’infezione |
Contatto diretto con epidermide e mucose attraverso il pulviscolo |
Inalazione |
Tabella 7: Caratteristiche degli aerosol prodotti da strumenti rotanti ad alta velocità.
Tali strumenti sono in grado di generare microgocce di aerosol di diverse dimensioni: le più piccole ovviamente rimangono per più tempo sospese nell’aria e sono responsabili della trasmissione di malattie attraverso l’inalazione, mentre le più grandi, che rapidamente cadono e bagnano le superfici, possono trasmettere microrganismi attraverso la pelle o le mucose (Signoretto, 1994).
Appare evidente, allora, la consistenza di questa problematica fino a farla considerare oggi una delle principali cause della contaminazione delle superfici e dei componenti dello staff odontoiatrico (Belting, 1964; Timbrell, 1973). È ben nota da tempo la necessità quindi di attuare la disinfezione anche quotidiana dei suddetti locali con un sistema efficace ma nello stesso tempo il più semplice possibile, di rapida attuazione e a costi ragionevoli. Tra questi metodi rientrano la disinfezione manuale delle superfici di appoggio e dei pavimenti con vari disinfettanti di solito dispersi in qualche soluzione, l’utilizzo di lampade germicide (UV), l’aerosolizzazione di sostanze disinfettanti ad opera di opportuni strumenti.
Nel lavoro di Signoretto (Signoretto, 1994) è stata valutata l’efficacia di abbattimento della carica microbica effettuata da un apparecchio per l’emissione di aerosol a base di fenoli o di clorexidina.
I risultati ottenuti hanno mostrato l’efficacia di un simile strumento non solo nel ridurre di oltre il 90% la carica batterica inizialmente presente, ma soprattutto nel determinare la totale scomparsa della flora batterica di origine salivare.
4.13 Protocolli di gestione del riunito
I riuniti odontoiatrici non sono soltanto "macchine" che devono semplicemente "funzionare" ma sono anche e soprattutto Dispositivi Medici che hanno applicazione diretta sull'uomo.
Ecco perché l'utilizzo dell'attrezzatura deve essere regolato da precisi protocolli che comprendano gli aspetti igienici dell'uso quotidiano del riunito e degli strumenti, affinché le corrette condizioni igieniche, fondamentali per il controllo dei rischi di infezione, siano sempre garantite. I protocolli sono organizzati secondo le tempistiche di esecuzione, con l'indicazione di procedure giornaliere, le operazioni da effettuare quotidianamente (all'inizio, dopo ciascun paziente, alla fine della giornata lavorativa) e di procedure a scadenze, da effettuare in periodi diversificati secondo i casi, una volta alla settimana, al mese, all'anno (tabella 8).

Tabella 8: Un protocollo di gestione del riunito.
Queste informazioni sono essenziali e costituiscono un vademecum indispensabile, da conservare, consultare e applicare, per operare sempre nelle migliori condizioni di sicurezza e garantire al paziente ed al personale odontoiatrico il più alto livello di tutela.
5.1 Le norme armonizzate: aspetti generali
Le attività sanitarie in ambito odontoiatrico sono disciplinate dalle normative CEE con la Direttiva 93/42 recepita in Italia dal Decreto Legislativo 46/97 (del 24 febbraio 1997) modificato con il Decreto Legislativo 95/98 (del 25 febbraio 1998).
La Direttiva 93/42 CEE regolamenta l’immissione in commercio e l’utilizzo dei dispositivi medici. Tale normativa fornisce importantissime indicazioni riguardanti la sterilizzazione, norme che debbono essere applicate da chi si occupa di tale problematica.
Gli articoli che interessano in modo particolare la sterilizzazione e la gestione in senso lato dei dispositivi medici sono:
· l’art. 4 del suddetto decreto il quale specifica che: “I dispositivi devono soddisfare i requisiti essenziali prescritti nell’allegato I in considerazione della loro destinazione”.
· l’art. 6 che chiarisce: “ Si presume conforme ai requisiti essenziali di cui all’articolo 4 il dispositivo fabbricato in conformità delle norme armonizzate comunitarie e delle norme nazionali che le recepiscono”.
La direttiva obbliga inoltre i fabbricanti di dispositivi medici a fornire agli utilizzatori istruzioni dettagliate sulle modalità di utilizzo, trattamento, sterilizzazione, ecc. dei dispositivi stessi, in modo tale che essi rimangano sempre conformi ai citati requisiti.
A tal proposito, così recita l’Allegato I al punto 13.6 - lettera h: “Le istruzioni per l’uso devono contenere, ove necessario, le seguenti istruzioni: se un dispositivo è destinato ad essere riutilizzato, le informazioni relative ai procedimenti appropriati ai fini della riutilizzazione, compresa la pulizia, la disinfezione, l’imballaggio e, ove necessario, il metodo di sterilizzazione; se il dispositivo deve essere risterilizzato, le eventuali restrizioni sul numero delle riutilizzazioni possibili. Qualora vengano forniti dispositivi che devono essere sterilizzati prima dell’uso, le istruzioni relative alla pulizia e alla sterilizzazione devono essere tali, se seguite correttamente, da permettere al dispositivo di essere sempre conforme ai requisiti di cui alla parte I ”.
Un altro passo interessa da vicino la sterilizzazione: nell’allegato I, al punto 8.4, viene stabilito che “ I dispositivi forniti allo stato sterile devono essere fabbricati e sterilizzati con un metodo convalidato e appropriato”.
Si chiarisce in tal modo il rapporto tra adempimenti di legge ed applicazione delle norme armonizzate europee. Con l’introduzione della direttiva europea in questione le norme armonizzate assumono finalmente tutta la loro reale rilevanza: esse rappresentano attualmente la guida più aggiornata ed efficace per affrontare le problematiche della sterilizzazione in un contesto di qualità, esprimendo “lo stato dell’arte” in materia di sterilizzazione (D.L.vo 46/97, 1997).
5.2 Norme armonizzate di riferimento per la sterilizzazione a vapore
La Gazzetta Ufficiale della Comunità Europea, nel numero del 26 giugno 1999, pubblica l’elenco delle norme armonizzate di riferimento per la sterilizzazione a vapore, che sono principalmente:
1. EN 285 “Sterilizzazione – Sterilizzatrici a vapore – Grandi sterilizzatrici”.
2. EN 554 “Sterilizzazione dei dispositivi medici – Metodo per la convalida e per il controllo sistematico della sterilizzazione a vapore”.
3. EN 556 “Sterilizzazione dei dispositivi medici – Requisiti per i dispositivi medici che recano l’indicazione STERILE” (UNI EN 554, 1994; UNI EN 556, 1994; UNI EN 285, 1996).
La Norma UNI EN 556 è la norma guida sulla sterilizzazione. Quattro sono, i concetti fondamentali espressi:
1. Il concetto di sterile: “un articolo o un prodotto è considerato sterile quando è privo di microrganismi vitali”;
2. La norma evidenzia poi la probabilità teorica che particolari microrganismi possano sopravvivere al termine del trattamento di sterilizzazione, dal momento che esso può essere assimilato ad un processo con andamento esponenziale; in altre parole, esiste sempre una probabilità finita che un microrganismo possa sopravvivere qualunque sia l’efficacia del trattamento applicato.
Per un dato trattamento, la probabilità di sopravvivenza è determinata dal numero e dai tipi di microrganismi e dall’ambiente in cui essi si trovano durante il trattamento. Ne consegue che la sterilità di ogni articolo appartenente ad una popolazione di articoli sottoposti a sterilizzazione non può essere garantita e la sterilità di tale popolazione deve essere definita in termini di probabilità di esistenza di un articolo non sterile in quella stessa popolazione.
In relazione a ciò, la Commissione della Farmacopea Europea afferma che un prodotto può essere considerato sterile quando è presente un livello teorico di non più di un microrganismo vivente in 1 x 106 unità sterilizzate del prodotto finale.
3. La serie EN 29000, relativa al sistema di qualità per la progettazione/sviluppo, la produzione, l’installazione e l’assistenza dei dispositivi medici, designa come “speciali” certi processi di produzione caratterizzati dal fatto che il loro risultato non può essere interamente verificato da ispezioni e prove finali sul prodotto.
La sterilizzazione è un esempio di processo “speciale” perché l’efficacia del processo stesso non può essere verificata per mezzo di ispezioni e di prove sul prodotto. Pertanto tali processi “speciali” debbono essere convalidati prima dell’utilizzo del prodotto, il controllo del funzionamento deve essere eseguito regolarmente e l’apparecchiatura sistematicamente controllata.
4. Infine, è importante sapere che l’esposizione ad un processo di sterilizzazione correttamente convalidato ed accuratamente controllato non è il solo fattore che permette di assicurare che il prodotto sia sterile e, di conseguenza, adatto all’uso. Si deve fare attenzione ad ulteriori fattori che comprendono lo stato microbiologico (carica e tipizzazione microbiologica) delle materie prime e/o dei componenti, il loro successivo immagazzinamento ed il controllo dell’ambiente in cui l’articolo viene fabbricato, assemblato e confezionato (ISS, 2001).
La Norma UNI EN 285 “Sterilizzazione – Sterilizzatore a vapore – Grandi sterilizzatori” definisce le caratteristiche delle autoclavi a vapore adatte a sterilizzare dispositivi confezionati (strumenti, carichi porosi, ecc.) che abbiano la camera atta a contenere almeno una unità di sterilizzazione (300x300x600 mm).
Tale norma fornisce indicazioni sui materiali di costruzione, sui cicli di controllo e di sterilizzazione, con particolare riguardo alle fluttuazioni di temperatura e alle modalità di registrazione dei parametri (temperatura, pressione e tempo); vengono inoltre descritti i materiali, le modalità di esecuzione ed i limiti dei test di tipo; i controlli da effettuare per la messa in servizio, per il monitoraggio giornaliero e per quello periodico.
Le caratteristiche tecniche delle autoclavi di dimensioni inferiori ad una unità di sterilizzazione, quelle utilizzate più comunemente negli ambulatori odontoiatrici, sono invece fornite dalla norma preliminare prEN 13060 che è ancora in fase di approvazione formale. La norma, oltre a indicazioni di carattere generale, fornisce indicazioni relative alla sterilizzazione dei diversi materiali, in particolare materiali pieni, materiali cavi con rapporto definito lunghezza/sezione, materiali porosi e/o confezionati.
L’andamento dei cicli di controllo e di sterilizzazione descritto in questa serie di norme non differisce da quello della UNI 285, almeno per quanto riguarda i principi generali. Anche in questo caso i cicli debbono essere gestiti da due sonde termometriche di controllo indipendenti mentre il range di fluttuazione della temperatura è tra 0 e + 4 °C (UNI EN 285, 1996; ISS, 2001).
La Norma UNI EN 554 definisce i requisiti per lo sviluppo, la convalida, la regolazione e il controllo del processo di sterilizzazione a calore umido dei dispositivi medici. Il metodo si basa sul controllo dei fattori fisici che conferiscono sterilità al prodotto e presuppone che, prima della convalida, la sterilizzatrice e la sua installazione siano risultate conformi a specifiche appropriate.
Questa norma non indirizza verso prove sistematiche su campioni (prove di sterilità) o all’uso di indicatori biologici in quanto, tranne che in un numero ridotto di applicazioni speciali, queste pratiche sono di limitato valore nella sterilizzazione a calore umido. In queste applicazioni speciali le pratiche citate dovrebbero essere considerate come supplementari alle misure dei parametri fisici (UNI EN 556, 1994; ISS, 2001).
5.3 Caratteristiche di un autoclave a vapore, convalida e controlli
Come già precedentemente descritto, la sterilizzazione è il processo che porta alla distruzione di tutti i microrganismi, comprese le spore. Rappresenta l’intervento di “prima scelta” da preferire in tutti i casi in cui possa essere applicato. La sterilizzazione fisica si può realizzare con calore umido (autoclave).
Recentemente il Gruppo di Lavoro in ambito CEN ha definito che i cicli di sterilizzazione devono essere distinti in 3 categorie in funzione del tipo di materiale da sterilizzare:
- ciclo di tipo B per strumenti solidi, corpi cavi e materiali porosi;
- ciclo di tipo N per strumenti solidi;
- ciclo di tipo S per carichi definiti dal produttore secondo le indicazioni di norma.
La temperatura dei cicli di sterilizzazione deve essere per tutto il tempo di esposizione al di sopra del valore nominale normalmente fissato a 121°C o a 134°C. La pressione deve essere sempre coerente con le temperature misurate.
È indispensabile che l’apparecchiatura sia dotata di un sistema di autovalutazione del processo che interrompa automaticamente il ciclo qualora venga rilevata una anomalia di funzionamento. È opportuno, inoltre, dotare l’apparecchiatura di una stampante direttamente collegata a sensori indipendenti da quelli dell’autoclave.
Le caratteristiche tecniche affinchè una autoclave a vapore sia idonea alla sterilizzazione di dispositivi medici cavi e porosi e/o confezionati possono essere così riassunte:
1) Cicli di controllo predisposti:
- test vuoto;
- Helix test (per corpi cavi);
- test Bowie-Dick (per corpi porosi);
2) Cicli di sterilizzazione (cosiddetti cicli in classe B perché idonei alla sterilizzazione di materiale cavo e poroso) con le seguenti caratteristiche:
- identico vuoto frazionato impostato nel ciclo di controllo Helix test;
- tempi di plateau (tempo di raggiungimento della temperatura di sterilizzazione) ≤ 15 secondi;
- tempo effettivo di sterilizzazione di almeno 4 minuti a 134°C ed almeno 15 minuti a 121°C;
- la banda di temperatura nel tempo di sterilizzazione non deve mai scendere sotto la temperatura nominale e mai superarla di più di 4°C; il tempo di asciugatura deve essere idoneo a far sì che il materiale sia perfettamente asciutto con un carico standard e l’umidità residua non deve superare lo 0,2 % del peso del materiale stesso;
- il ripristino atmosferico deve essere effettuato tramite filtro assoluto.
È opportuno, inoltre, che l’apparecchiatura sia dotata di un generatore di vapore esterno alla camera di sterilizzazione e di un programmatore che segnali il completamento del ciclo ed eventuali anomalie tecniche che rendano quindi il ciclo non valido.
La stampata del report di sterilizzazione è un optional e non è indispensabile; comunque è importante che l’apparecchiatura evidenzi il numero di ciclo progressivo effettuato (UNI EN 285,1996; ISS, 2001).
Relativamente alla convalida la norma UNI EN 554 (“Metodo per la convalida e per il controllo sistematico della sterilizzazione a vapore”) specifica i controlli che devono essere effettuati in fase di convalida dell’apparecchiatura ovvero accettazione e qualifica.
Di solito l’accettazione (ovvero la messa in funzione dell’autoclave) viene effettuata dal produttore.
La qualifica deve essere eseguita all’atto della messa in servizio effettuando, almeno annualmente e dopo ogni manutenzione sostanziale dell’apparecchiatura, i seguenti test:
a) Verifica della taratura della strumentazione.
b) Test di tenuta del vuoto. Questo test serve a verificare l’assenza di infiltrazione di aria in camera. Si effettua introducendo in camera una sonda certificata di temperatura e di pressione ed avviando l’apposito ciclo predisposto dall’apparecchiatura.
c) Test Helix (giornaliero) (penetrazione del vapore in tubi ciechi, di lunghezza 1,5 m con lume di diametro 2 mm).
d) Mappatura delle temperature in camera, individuando il punto più freddo mediante l’introduzione, in camera vuota, di sonde di temperatura e di pressione in un ciclo a 134°C ed in un ciclo a 121°C.
e) Qualifica fisica, introducendo in camera sonde certificate di temperatura e di pressione direttamente nel carico standard, certificando la riproducibilità di 3 cicli di sterilizzazione consecutivi, rispettivamente a 134°C e a 121°C.
f) Test di umidità residua per metalli, eseguito in uno dei tre cicli a 134°C.
La qualifica microbiologica e l’analisi di sterilità del prodotto sono facoltative e ammesse come verifiche opzionali e non vincolanti.
È importante, ad ogni modo, che l’operatore odontoiatrico effettui quotidianamente prima dell’inizio dell’attività il Test Helix e ne conservi, per fini medico-legali, la documentazione.
Il fallimento di tale prova impone la messa fuori servizio dell’apparecchiatura per la sterilizzazione di corpi cavi e materiale confezionato (UNI EN 554, 1994; ISS, 2001).
L’autoclave deve essere sottoposta a controlli routinari per valutare il suo corretto funzionamento.
È prioritario seguire le indicazioni del fabbricante dell’apparecchiatura descritte nel manuale d’uso (manutenzione, acqua da utilizzare, installazione, etc.).
I test da effettuare sull’autoclave e le indicazioni per una corretta gestione sono i seguenti:
1) effettuare un ciclo (breve) per riscaldare l'autoclave;
2) effettuare l'Helix Test;
3) inserire il materiale confezionato in camera evitando di ammassarlo;
4) non superare il carico massimo consentito e comunque sottoposto a convalida;
5) posizionare le buste contenenti gli strumenti orizzontalmente e per non più di 3-5 buste sovrapposte per ogni ripiano, facendo combaciare sempre carta/carta e polimero/polimero;
6) chiudere la porta dell'autoclave ed attendere alcuni minuti (cinque) prima di selezionare ed avviare il ciclo;
7) a ciclo valido aprire la porta di pochi centimetri ed attendere alcuni minuti prima di estrarre il materiale;
8) etichettare le confezioni con numero di lotto di sterilizzazione e data di scadenza;
9) sottoporre annualmente a qualifica fisica l'apparecchiatura per i cicli che si intendono utilizzare (ISS, 2001).
In fine tutte le confezioni sottoposte a sterilizzazione ed i cicli eseguiti devono riportare un numero di lotto di sterilizzazione e la data di scadenza della confezione.
Questi dati devono essere riportati sulla singola confezione, nel registro di sterilizzazione, nel documento di sterilizzazione.
5.4 Immunoprofilassi dell’ epatite B
L’Art.1 del Decreto del Ministero della Sanità del 4 ottobre 1991 prevede che: “La vaccinazione antiepatite B deve essere offerta gratuitamente : … omissis… h) al personale sanitario di nuova assunzione nel Servizio Sanitario Nazionale ed al personale del Servizio Sanitario Nazionale già impegnato in attività a maggior rischio di contagio e segnatamente che lavori in reparti di emodialisi, rianimazione, oncologia, chirurgia generale e specialistica, ostetricia e ginecologia, malattie infettive, ematologia, laboratori di analisi, centri trasfusionali, sale operatorie, studi dentistici ecc.” (Ministero della Sanità, 1991).
Il Decreto del Ministero della Sanità del 20 novembre 2000 prevede che per gli operatori sanitari che abbiano contatti con pazienti o con materiale ematico ed altri fluidi biologici, e che siano esposti continuamente al rischio di lesioni con aghi o strumenti taglienti, è opportuna l’esecuzione di un test, anche solamente qualitativo, per la valutazione della risposta anticorpale a distanza di 1-2 mesi dall’ultima dose del ciclo vaccinale di base.
Tale test non è invece indicato per i nuovi nati, gli adolescenti e gli adulti mentre, anche ai fini medico-legali e di valutazione dell’idoneità lavorativa specifica, è opportuna la sua esecuzione nelle persone, vaccinate nel passato, al momento dell’inizio dell’attività come operatore sanitario.
Qualunque sia il tempo trascorso dal completamento del ciclo primario di vaccinazione, in caso di positività del test per la ricerca degli anticorpi anti-HBs, non sono necessarie dosi di richiamo della vaccinazione contro l’epatite virale B né ulteriori controlli dello stato immunitario. In caso di negatività del test per la ricerca degli anti-HBs, negli operatori sanitari, è indicata la somministrazione di una quarta dose di vaccino contro l’epatite virale B, con ulteriore valutazione del titolo anticorpale a distanza di 1-2 mesi. In caso di persistenza di negatività del test, non sono indicate ulteriori somministrazioni di vaccino (figura 32).
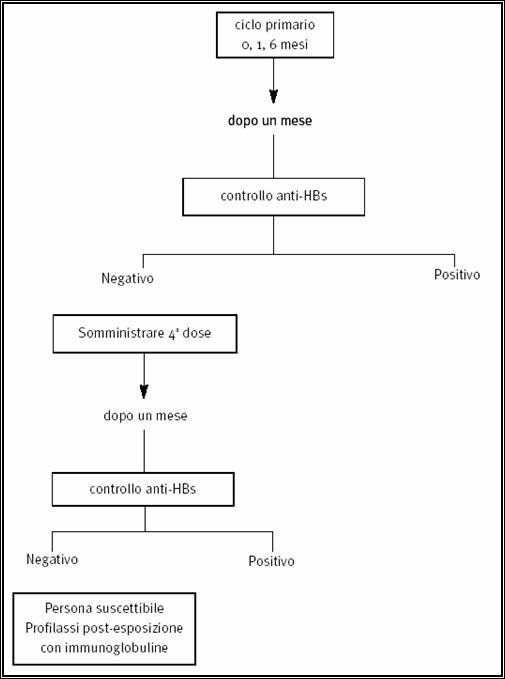
Figura 32: Schema di comportamento per l’esecuzione della vaccinazione contro l’epatite virale B in particolari categorie di persone (operatori sanitari con continue esposizioni a rischio di lesioni da strumenti taglienti, immunodepressi, emodializzati).
Il soggetto che non ha risposto alla vaccinazione deve essere considerato suscettibile all’infezione da virus dell’epatite B ed essere informato circa la necessità, in caso di esposizione accidentale al virus, di profilassi post-esposizione basata sulla somministrazione di immunoglobuline specifiche (Ministero della Sanità, 2000).
Per quanto riguarda lo schema di trattamento profilattico post-esposizione, questo è diverso a seconda che le persone siano state, o meno, vaccinate in precedenza contro l’epatite virale B.
Nelle persone vaccinate in precedenza e di cui non si conoscano i dati in risposta al ciclo primario di immunizzazione, si consiglia, in caso di esposizione accidentale a virus dell’epatite B, la somministrazione di immunoglobuline specifiche insieme ad una dose di vaccino, con esecuzione del test anti-HBs a distanza di almeno un mese.
Per le persone non vaccinate il trattamento post-esposizione prevede, oltre alle immunoglobuline specifiche, il ciclo accelerato di vaccinazione, con somministrazione del vaccino ai tempi 0, 1, 2 mesi, con dose di rinforzo dopo 6-12 mesi di distanza dalla terza dose.
Le immunoglobuline specifiche vanno, quindi, somministrate contemporaneamente alla prima dose di vaccino, ma in sede corporea e con siringhe diverse.
In caso di mancanza delle immunoglobuline specifiche per via intramuscolare, è possibile utilizzare, a scopo profilattico, anche le immunoglobuline specifiche per via endovenosa, conformemente a quanto riportato nei foglietti illustrativi di ogni singolo prodotto (ISS, 2001).
Relativamente allo smaltimento dei rifiuti negli studi odontoiatrici il Decreto Legislativo 5 febbraio 1997 n. 22 (D.L.vo 22/97, 1997) e successive modifiche prevede i seguenti adempimenti:
- sottoscrizione con ditta autorizzata di contratto per lo smaltimento di rifiuti sanitari pericolosi (per produzione inferiore ai 200l, il ritiro deve essere mensile), quello dei rifiuti speciali pericolosi (per i liquidi di sviluppo e fissaggio il ritiro di quantitativi non superiori ai 10 m3 è annuale);
- istituzione di Registro di Carico e Scarico di Rifiuti Pericolosi ove vanno annottati settimanalmente i quantitativi di rifiuti prodotti con il loro relativo codice CER di identificazione e mensilmente i quantitativi conferiti al trasportatore per l’avvio allo smaltimento finale mediante termodistruzione. N.B. al conferimento dei rifiuti al trasportatore occorre compilare, in quattro copie, il formulario di identificazione;
- domanda al Comune (presso la Circoscrizione) per la detassazione dalla tassa N.U. delle superfici dello studio ove vengono prodotti i rifiuti pericolosi (su apposito modulo, con allegata pianta dello studio scala 1:50 e copia del contratto per il trasporto e smaltimento dei rifiuti pericolosi).
5.6 Il controllo della applicazione delle misure preventive
Il controllo sull’effettiva applicazione delle misure di prevenzione delle infezioni in odontoiatria è particolarmente complesso, per la presenza di alcune condizioni molto particolari:
- l’odontoiatria costituisce un’attività esercitata in larga misura in sede extraospedaliera, e dunque di più difficile controllo;
- si tratta della disciplina che comporta normalmente le manovre invasive più diffuse in ambito extraospedaliero. Se in ospedale si hanno a disposizione attrezzature e numero di operatori tali da garantire tutte le procedure ottimali in merito alla sterilizzazione, in un singolo ambulatorio è oggi impossibile ipotizzare l’utilizzo di autoclavi con caratteristiche pari a quelle dei comparti operatori, così come è problematico ipotizzare analoga organizzazione degli spazi, dei percorsi sporco/pulito, ecc;
- è purtroppo ancora presente la pratica dell’abusivismo (e, quasi simmetricamente, del prestanomismo); in chi non ha l’abilitazione a svolgere la professione odontoiatrica, le conoscenze, anche in materia di prevenzione delle infezioni, sono più limitate e più facilmente si possono evadere i costi necessari ad una corretta profilassi;
- il numero di persone che si sottopone a pratiche odontoiatriche è molto alto: sono ormai poche le persone che non vanno regolarmente dal dentista, e ancora meno quelle che non ne hanno mai avuto necessità. In altre parole, se il rischio infettivo per il singolo paziente è relativamente modesto, l’esposizione complessiva della popolazione è però molto alta.
Tale situazione impone quindi un interesse da parte della Sanità Pubblica, volto a limitare il rischio di trasmissione di infezioni, sia ai pazienti (infezioni crociate oppure trasmesse dall’operatore) sia agli operatori stessi (infezioni occupazionali) (ISS, 2001).
Per stimolare e promuovere la riduzione del rischio infettivo da più parti provengono proposte, anche in vista dell’armai nota Quality Assurance (QA) o Verifica e Revisione della Qualità (VRQ), di applicare anche agli studi odontoiatrici i criteri di qualità dell’ “accreditamento” (Marci, 1996).
Il concetto di accreditamento è stato introdotto per la prima volta in Italia con il D.L.vo n. 502/92.
L’accreditamento va inteso come la volontà di garantire una verifica ed un monitoraggio delle strutture che forniscono prestazioni nell’ambito del SSN.
Fino al 1996 l’accreditamento è stato automaticamente riconosciuto per le strutture pubbliche o private con un precedente rapporto di convenzione con il SSN.
Con la pubblicazione del DPR 14.01.1997, che definisce i requisiti minimi strutturali, tecnologici ed organizzativi, le strutture di nuova realizzazione devono da subito attenersi ai requisiti specificati, così pure quelle che attuano ampliamenti o modifiche.
Le altre strutture devono adeguarsi entro un massimo di cinque anni.
Sono interessate tutte le strutture sanitarie, da quelle che erogano prestazioni in regime di ricovero, a ciclo continuativo e/o diurno, a quelle di assistenza specialistica in regime ambulatoriale, che erogano prestazioni riabilitative, di diagnostica strumentale e di laboratorio, a quelle che operano in regime residenziale.
Con il DPR 14.01.1997 sono state fissate due tappe:
- l’autorizzazione obbligatoria che implica il possesso dei requisiti minimi;
- l’accreditamento, volontario, che riconosce i fornitori, cioè coloro che possono erogare prestazioni per conto del SSN, e che implica il possesso di requisiti ulteriori, definiti dalle Regioni.
1. Abel L.C., Miller R.L., Micik R.E.: Studies on dental aerobiology: bacterial contamination of water delivered by dental units. J. Dent. Res., 50: 1576-1569, 1971.
2. ADA Council and Scientific Affairs and ADA Council and Dental Practice: Infection Control Recommentation for the dental office and the dental laboratory. J Am Dent Assoc, 127: 672-680; 1996.
3. ADA Dipartment of State Government Affairs: Five States move quickly on handpiece sterilization Assoc, 123: 119-120; 1992.
4. ADA: Infection control recommendations for dental office and the dental laboratory. JADA, 116: 241-248, 1998.
5. A-dec: Clean water system operation and maintenance instructions. Publication #85-0675, A-dec, Newberg, Ore, 1988.
6. America Dental Association: ADA statement on dental unit waterline. JADA, 127: 185-186, 1996.
7. Association Reports: Infection control in the dental office. JADA, 97: 673-674, 1978.
8. Atlas R.M., Wolliams J.F., Huntington M.K.: Legionella contamination of dental-unit water. Appl Environ Microbiol, 61: 1208-1211, 1995.
9. Bagga B.S.R., Murphy R.A., Anderson A.W.: Contamination of dental unit cooling water with oral microorganism and its prevention. JADA, 109: 712-716, 1984.
10. Bagga B.S.R., Murphy R.A., Anderson A.W.: Contamination of dental unit cooling water with oral microorganism and its prevention. JADA, 109: 712-716, 1984.
11. Barbera e coll. A.S.L 13 - Ospedali Riuniti Livorno: L’AIDS e l’operatore sanitario, 1992.
12. Belting C., Haberfelde G., Juhi L.: Spread of organism from dental air rotor. J Am Dent Ass, 68: 648; 1964.
13. Bentley CD, Burkhart NW, Crawford JJ.: Evaluating spatter and aerosol contamination during dental procedures. J Am Dent Assoc, 125(5): 579-84, 1994.
14. Bergese F.: Manutenzione e disinfezione degli impianti e dello strumentario dentale. Il Dentista Modermo, 7: 28-31, 1994.
15. Bombarda G., Bergonzi G.M., Pelisi C., Trattini F.: Epatite C.Implicazioni odontoiatriche. Dental Cadmos, 4: 60-73, 1996.
16. Bond W.W., Favero M.S., Petersen N.J.: Survival of Hepatitis B virus after drying and storage for one week. Lancet 7: 50-51, 1981.
17. Borneff M.: Hygiene problems in dental practice with special attention to dental units. Zentralbl Bakteriol Microbiol Hyg, 183: 130-152, 1986.
18. Burke F.J.T., Coulter W.A., Cheung S.W.: Autoclave performance and practitioner knowledge of autoclave use: A survey of selected UK practices. Quintessence Int, 29: 231-238; 1998.
19. Carducci A., Ruschi M.A., Avio C.M., Marelli P., Grasso A.: Controllo Microbiologico ambientale in un ambulatorio odontoiatrico. L’igiene Moderna, 99: 367-376, 1993.
20. CDC: Recommended infection control practices for dentistry. MMWR, 35: 237-242, 1985.
21. CDC: Recommendations for prevention of HIV transmission in health-care settings. MMWR 36: 10-11, 1987.
22. Centers For Disease Control: Guidelines for prevention of Transmission of Human Immunodeficiency Virus and Hepatitis B Virus to Health Care and Public-safety Workers. MMWR, 38: 5-6, 1989.
23. Centers For Disease Control: Recommendations for preventing transmission of Human Immunodeficiency Virus and Hepatitis B Virus to patients during exposure-prone invasive procedures. MMWR, 40(RR-8), 1991.
24. Centers for Disease Control: Recommended Infection-Control Practices for Dentistry. MMWR, 42:(RR8), 5-28, 1993.
25. Centers for Disease Control: Guidelines for Infection Control in Dental Health Care-Settings. MMWR, 52 (No.RR-17): 1-61, 2003.
26. Characklis W.G., Marshall K.C.: Biofilms. New York, John Wiley and Sons Inc., 1990.
27. Checchi L., Montebugnoli L., Samaritani S.: Contamination of the turbine air chamber: a risk of cross infection. J Clin Periodontol, 25: 607-611, 1998.
28. Collegio dei docenti di odontoiatria e ADI: Recenti progressi nella ricerca odontoiatrica in Italia (volume II): Il controllo dell’infezione crociata nei dispositivi medici per odontoiatria. Atti del VII congresso nazionale del collegio dei docenti di odontoiatria, Ed. ADI, Roma; marzo 2000.
29. Costerton J.W., Cheng N.J., Geesey G.G.: Bacterial biofilms in nature and disease. Annu Rev Microbiol, 41: 435-464, 1987.
30. Costerton J.W., Stewart PS., Greenberg EP.: Bacterials biofilms: a common cause of persistent infections. Science, 284 (5418): 1318-22, 1999.
31. Council on Dental Materials, Instruments and Equipment: Dental units and water retraction. JADA, 116: 417-420, 1988.
32. Crawford J.J.: Clinical asepsis in dentistry. Dallas Kolstad RA, 1978.
33. Decreto Legislativo 24/2/1997 n. 46. Attuazione della direttiva 93/42/CEE concernente i dispositivi medici. GU n. 54, suppl. ordinario, serie generale, 3 marzo 1997.
34. Decreto Legislativo 5/2/1997 n. 22. Gazzetta Ufficiale n. 181 del 4 agosto 1997.
35. Decreto Ministero della Sanità 28/9/90: Norme di protezione dal contagio professionale da HIV nelle strutture sanitarie e assistenziali pubbliche e private. GU n. 235, serie generale, 8 ottobre 1990.
36. Dolci G., Testarelli L.: Air-borne infection in dental practice: a disregarded risk. U & U Journal of Dental University and Italian Dental Industries Association, 2 (II): 11-21, 2002.
37. Dolci G., Testarelli L.: La prevenzione dell’infezione crociata negli strumenti e nei riuniti odontoiatrici. DOCTOR OS, Supplemento, 2003 Settembre.
38. Dubois F., Desenclos J., Mariotte N.: Hepatitis C in French population-based survey, 1994 : sieroprevalence, frequency of viremia, genotype distribution and rysk fectors. Hepatology, 25: 1490-1496, 1997.
39. Ely E.W., Stump T.E., Hudspeth A.S.: Thoracic complications of dental surgical procedures: hazards of the dental drill. Am J Med, 95: 456-465; 1993.
40. Engelhardt F.P., Fisvatin H.: Hygene in der Zahnartzpraxis-Wunsch und Wirklichkeit. Dtsch Zahnarztl Z, 31: 277-281; 1976.
41. Fausti G., Grottolo M., Renzi D., Monarca S., Paganelli C., Sorlini L.: Monitoraggio della contaminazione microbica ambientale negli studi odontoiatrici dell’Azienda USL n. 16 della Lombardia. Atti del 37° Congresso Nazionale “L’igiene e la Sanità Pubblica alle soglie del 2000”, SitI, Napoli, 25-28 settembre 1996.
42. Fotos P.G., Westfall H.N., Snyder I.S.: Prevalence of Legionella-specific IgG and IgM antibody in a dental clinic population. J Dent Res, 64: 1382-1385, 1985.
43. Francetti L., Sironi R., Lasagni S., Carnemolla F.: Considerazioni sulle infezioni virali in ambito odontoiatrico. Prevenzione & assistenza dentale, 6: 21-26, 1993.
44. Gasparini R., Pozzi T., Bonanni P., Martini P., La Cava C., Lorenzoni L., Mazzini M.: Study on the hygienic conditions of dentist offices in the province of Siena in the years 1992-1993. Journal of Preventive Medicine and Hygiene, 36 N. 1/2:15-23, 1995.
45. Gasparini R., Pozzi T., Montomoli E., Fragapane E., Inghilterra P., Lorenzoni L., Polisenso G., Greco G., Cannone G., Bonanni P.: Occupational Risk for Hepatitis B and C among dental staff in the province of Siena (Italy). L’igiene Moderna, 112: 681-694, 1999.
46. Getchell-White S.I., Donowitz L.G., Groschel D.H.M.: The inanimate environment of an intensive care unit as a potential source of nosocomial bacteria: evidence for long-survival of Acinetobacter calcoaceticus. Infect. Control. Hosp. Epidemiol. 10: 402-407, 1989.
47. Girotti S., Zanetti F., Stampi S., Ferri E. Fini F., Roda A.: ATP bioluminescence for the rapid assessment of microbial content in wastewater and sludges. In: ATP 96 An International Symposium on Industrial Applications of Bioluminescence in Microbiology. Beaumont Conference Centre, London, 25-26 June; 1996.
48. Gori F.: Progettare la qualità in sanità: metodologie a confronto. http://www.renalgate.it/Gori_QUALITA.htm.
49. Griffiths P.A., Babb J.R., Bradley C.R.: Glutaraldehyde resistant Mycobacteriun Chelonae from endoscope kasher disinfectors. J. Appl. Microbiol. 85: 519-526, 1997.
50. Hanson P.J.V.: Mycobacteria and AIDS. Br. J. Hosp. Med. 40: 149, 1988.
51. Health Canada: Infection control guidelines: Hand washing, cleaning, disinfection and sterilization in health care. Ottawa 1998.
52. Herbert A.M., Walker D.M.,Davies K.J., Bagg J.: Occupational ly acquired hepatitis C virus infection. Lancet, 339: 305, 1992.
53. Indian Public Law 123-1988: Dental on-site compliance review chek-list, Indianapolis. In Indiana State Department of Health, Dental Disciplinary Board, 1992.
54. Istituto Superiore di Sanità: Gestione intraospedaliera del personale HbsAg o AntiHCV positivo. ISTISAN Congressi 72: 1-30, 2000.
55. Istituto superiore di Sanità – Regione Marche - Raccomandazioni per la prevenzione delle infezioni in Odontoiatria. Ancona - giugno 2001.
56. Jensen P.A.: Evaluation of standard and modified sampling heads for the international PBI Surface Air Systembioaerosol samplers. Am Ind Hyg Assoc J, 56: 272-279; 1995.
57. Joklik W.K., Willett H.P., Amos D.B.: Ed Zinsser microbiology 20th ed Norwalk, Conn: Appleton and Lange, 501, 1992.
58. Klein R.S., Freeman K., Taylor P.E., Stevens C.E.: Occupational risk for hepatitis C virus infection among New York City dentists. Lancet, 338: 1539-42, 1992.
59. Kumer E., Cova M., Berveglieri M.: Prevenzione del rischio infettivo in odontoiatria. L’igiene Moderna, 102: 703-715; 1994.
60. Kuo M.Y., Hahn L.J. Hong C.Y., Kao J.H., Chen D.S.: low prevalence of hepatitis C virus infection among dentists in Taiwan. J Med Virol, 40: 3-10, 1993.
61. Legnani P., Checchi L., Dal bagno F., Ibarra Illanez M., Marinelli M.: Disinfezione su organismi aereodispersi: valutazione di un sistema integrato. Dental Cadmos, 61: 66-76; 1993.
62. Lewis D.L., Boe R.K.: Cross-infection risks associated with current procedures for using high-speed dental handpieces. J Clin Microbiol, 30: 401-406, 1992, a.
63. Lewis D.L., Arens M., Appleton SS., Nakashima K., Ryu J., Boe RK., Patrick JB., Watanabe DT., Suzuki M.: Cross-contamination potential with dental equipment. Lancet, 340: 1252-1254, 1992, b.
64. Lowry P.W., Blankenship R.J., Gridley W.: A cluster of Legionella sternal-wond infections due to postoperative topical exposure to contaminated tap water. N Engl J Med, 324: 109-113, 1991.
65. Luck P.C., Bender L., Ott M.: Analysis of Legionella pneumophila serogroup 6 strains isolated from a hospital warm water supply over a three-year period using genomic long-range mapping techniques and monoclonal antibodies. Appl Environ Microbiol, 57: 3226-3231, 1991.
66. Mackenzie C.D., Huntington M.K., Williams J.F.: Legionella contamination in dental unit waterlines: an associated fatality in a dentist. FASEBJ, 8: 908, 1994.
67. Maggiore C., Romeo U., Ripari F.: La sterilizzazione e la disinfezione nello studio odontoiatrico. Attualità Odontostomatologiche Edizioni Universitarie Romane, Anno XII n. 2: 9-12, 1996.
68. Mann G.L.B., Campbell T.L., Crawford J.J.: Backf1ow in low-volume suction lines: the impact of pressure changes. JADA, 127: 611-615, 1996.
69. Marci F., Giannoni M.: Prevenzione del rischio infettivo in ambiente odontoiatrico. Il Dentista Moderno, 7: 929-948; 1996.
70. Marshall K.C.: Biofilms: an overview of bacterial adhesion, activity and control at surfaces. ASM news, 58: 202-207, 1992.
71. Marshall K.C.: Microbial adhesion in biotechnological processes. Curr Opin Biotechnol 5: 296-301, 1994.
72. Martin M.V.: The significance of bacterial contamination of dental unit water system. Br Dent J, 163: 152-154, 1987.
73. Martin M.V., Reichelderfer M.: APIC guideline for infection prevention and control in flexible endoscopy. Am J Infect Control, 22: 19-38; 1994.
74. Martin M.V.: The air/water syringe: a potential source of microbial contamination. Br Dent J, 184: 278-279, 1998.
75. Matsuyama M., Usami T., Masuda K.: Prevention of infection in dental procedures. J Hosp Infect, 35: 17-25, 1997.
76. Mayo J.A., Oertling K.M., Andrieu S.C.: Bacterial biofilm: a source of contamination in dental air-water syringes. Clin Prev Dent, 12: 13-20, 1990.
77. Mc Erlane B., Rosebush W.J., Waterfield J.D.: Assessment of the effectiveness of dental sterilizers using biological monitors. J Can Dent Assoc, 58: 481-484; 1992.
78. Medical Devices Agency: Device Bulletin, DB 9605 (NI). London: Medical Devices Agency, Feb, 1997.
79. Mele A., Curti C., Moro M.L., D’Errico M.M., et al.: Raccomandazioni per la prevenzione delle infezioni in Odontoiatria. Ancona–giugno, 2001. http://www.regione.marche.it/sportello/sanita/PREVENZIONE.PDF
80. Melo LF., Bott TR., Fletcher M., Capdeville B.: Biofilms: Science and Technology. In: NATO ASI series E, Kluwer Academic Press, Dordorecht, The Netherlands, 1992.
81. Merchant V.A., Molinari J.A., Sabes W.R.: Herpetic Whitlow: report of a case with multiple recurrences. Oral Surg Oral Med Oral Pathol, 55: 568-571, 1983.
82. Miller C.H.: Cleaning, sterilization and disinfection: basics of microbial killing for infection control. J Am Dent Assoc, 124: 48-56; 1993.
83. Miller C.H., Sheldrake M.A.: The ability of biological indicators to detect sterilization failures. Am J Dent, 7: 95-97; 1994.
84. Miller C.H.: Infection control. Dent Clin North Am, 40: 437-451; 1996.
85. Miller L.A., Beebe J.L., Butler N.C.: Use of polymerase chain reaction in epidemiological investigation of Pontiac fever. J Infect Dis, 168: 769-772, 1993.
86. Miller R.L.: Characteristics of blood-containing aerosols generated by common powered dental instruments. Am Ind Hyg Assoc J, 56(7): 670-6, 1995.
87. Ministero della Sanità. Offerta gratuita della vaccinazione contro l’epatite virale B alle categorie a rischio. Decreto 4 ottobre 1991.
88. Ministero della Sanità. Protocollo per l’esecuzione della vaccinazione contro l’epatite virale B. Decreto 20 novembre 2000.
89. Molinari J.A.: Waterborne microorganisms: questions about health-care problems and solutions-part 2 Compendium 16: 131-132, 1995.
90. Molinari J.A.: Dental infection control at the year 2000. JADA 130: 1291-1298, 1999.
91. Montagna F., Manzato G.L., Zanetti S.: Prevenzione del rischio infettivo nel laboratorio odontotecnico. Lavorosalute, 9: 9-30, 1995.
92. Montebugnoli L., Borea G.: Diagnosi immediata di Epatite C nel paziente odontoiatrico. Dental Cadmos, 4: 15-29, 1999.
93. Montebugnoli L., Dolci G.: Anti-HCV antibodies are detectable in gengival crevicular fluid from HCV positive subjects. J Dent Res, 448, 2000, a.
94. Montebugnoli L., Dolci G.: Efficacia di un sistema automatico che impedisce il ristagno dell’acqua all’interno dei condotti idrici del riunito odontoiatrico. In: Il controllo della contaminazione crociata nei Dispositivi Medici per odontoiatria. Ed Studio Fontana, Roma 5: 5, 2000, b.
95. Montebugnoli L., Dolci G.: Sistemi antireflusso sono in grado di ridurre la contaminazione microbica della camera d’aria della turbina durante l’uso. In: Il controllo della contaminazione crociata nei Dispositivi Medici per odontoiatria. Ed Studio Fontana, Roma 5: 10, 2000, c.
96. Mosley J.W., Edwards V.M., Casey G.: Hepatitis B virus infection in dentists. N. Engl. J. Med. 293: 729-734, 1975.
97. Ojajarvi J.: Prevention of microbial contamination of the dental unit caused by suction into the turbine drive air lines. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 81: 50-52, 1996.
98. Oppenheim B.A., Sefton A.M., Gill O.N.: Widespread of Legionella Pneumophila contamination of dental stations in a dental school without apparent human infection. Epidemiol Infect, 99: 150-166, 1987.
99. Palenik C.J., King T.N., Newton C.W.: A survey of sterilization practices in selected endodontic offices. J Endod, 12: 206-209; 1986.
100. Palenik C.J., Miller C.H.: Improving the performance of the office sterilizer. Dent Asepsis Rev, 12: 1-2; 1991.
101. Paszko-Kolva C.: Risk of infection from dental handpieces. ASM News, 57: 287, 19991.
102. Payment P., Franco E., Richardson L. : Gastrointestinal health effects associated with the consumption of drinking water produced by point-of-use domestic reverse osmosis filtration units. Appl Environ Microbiol, 57: 945-948, 1991.
103. Piazza M., Borgia G., Picciotto L., Nappa S, Ricciarello S., Orlando R.: Detection of hepatitis C virus RNA by PCR in dental surgeries. J Med Virol, 45: 42-50; 1995, a.
104. Piazza M., Borgia G., Picciotto L.: Detection of Hepatitis C virus-RNA by polymerase chain reaction in dental surgeries. J. Med. Virol. 45: 40-42, 1995, b.
105. Piazza M., Guadagnino V., Picciotto L., Borgia G., Nappa S.: Contamination by hepatitis B surfaces antigen in dental surgeries. Brit Med J, 295: 953-958; 1987.
106. Pitzurra M., Pasquarella C., Savino A.: La contaminazione microbica nell’aria atmosferica delle sale operatorie. L’Igiene Moderna, 100: 713-767; 1993.
107. Pitzurra M., Savino A., Pasquarella C., Poletti L.: A new method to study the microbial contamination on surfaces. Hyg Med, 22: 77-92; 1997.
108. Pitzurra M., Pasquarella C., D’Alessandro D., Savino A.: La prevenzione dei rischi in sala operatoria. Società Editrice Universo, Roma; 1999.
109. Pozzi T., Chiavacci R., Nisi A.: Rischio di infezioni associate ad interventi in odontostomatologia. Rivista Italiana d’Igiene, 61: (3-4), 404-410, 2001.
110. Prevost AP., Robert M., Charland R.: Doctor, would you drink water from your dental unit?. N Y State Dent J, 61(10): 8-22, 1995 Dec.
111. Procopio C., Matterello R., Tassarotti B., Pignanelli M.: Disinfezione dei materiali da impronta: stabilità dimensionale. Dental Cadmos, 2:46-66, 1996.
112. Quinley E.D., Williams N.J., Ames L.L: The air/water syringe contamination and disinfection. Quintessence Int, 20: 911-916, 1989.
113. Regione Toscana, A.S.L. 10/A: La sterilizzazione in ambiente ospedaliero, 1992.
114. Reinthaler F., Mascher F.: Demostation of Legionellla Pneumophila in dental units. Zentralbl Bakteriol Mikrobiol Hyg, 183: 86-88, 1986.
115. Reinthaler F., Mascher F., Stunzner D.: Serological examinations for antibodies against Legionella species in dental personnel. J Dent Res, 67: 942-943, 1988.
116. Rongione G., Passagrilli B.: Prevenzione della sindrome da immunodeficienza acquisita (AIDS) ed altre patologie infettive negli studi odontoiatrici. Stabilimenti tipografici IN.GRA.C., marzo 1987.
117. Ruggenini A.M., Zotti C.: Il rischio di infezione da HIV in odontoiatria. In: Prevenzione professionale. Il Dentista Moderno 7/1988.
118. Runnels R.R.: Controllo dell’ infezione negli Studi Odontoiatrici. I.T.E. edit., Dolo (Ve), 1985.
119. Rutala W.A., Weber D.J.: Disinfection of endoscopes: Rewiev of new chemical sterilants used for high level disinfection. Infect Control Hosp Epidemiol, 20: 69-76; 1999.
120. Sagliocca L., Mele A., Moro M.L.: Linee guida per la prevenzione delle infezioni in odontoiatria. I.S.S. e Regione Campania, 1990.
121. Sagliocca L., Mele A.: Aspetti epidemiologici del rischio infettivo in odontoiatria. Il rischio infettivo in odontoiatria, Ed. F. Angeli, Milano: 16-20, 1993.
122. Scheid R.C., Rosen S., Beck F.M.: Reduction of CFUs in high speed handpiece water lines over time. Clin Prev Dent, 12: 9-12, 1990.
123. Scheutz F., Reinholdt J.: Outcome of sterilization by steam autoclaves in Danish dental offices. Scand J Dent Res, 96: 167-170; 1988.
124. Schiff E.R., De Medina M.D., Hill M.A.: Prevalence of anti HCV in the Va environment from 1979-1981. Hepatology, 12: 849-856, 1990.
125. Schram E., Van Witzenburg A.: Improved ATP methodology for biomass assys. J Biolumin Chemilumin, 4: 390-398; 1989.
126. Scott D.A., Coulter W.A., Lamey P.J.: Oral shedding of herpes simplex virus type 1: a review. J. Oral Pathol. Med. 26: 441-447, 1997.
127. Scotti A., Vecchi V.: Infezioni crociate nello studio odontoiatrico. Dental Cadmos, 2: 1992.
128. Shpuntoff H., Shpuntoff R.L.: High-speed dental handpieces and spread of airborn infections. NYSDJ, 1: 21-23, 1993.
129. Siebel MA., Characklis WG.: Observations of binary population biofilms. Biotechnol Bioeng, 37:778-789, 1991.
130. Signoretto C., Canepari P., Urbani G.: L’inquinamento microbiologico nell’ambulatorio odontoiatrico ed il suo possibile abbattimento. Minerva Stomatol, 43: 263-272; 1994.
131. Simonetti D’Arca A., Sebastiani Annichiarico L., Bellante G., Petti S., Tommasi E.: Contamination of dental units and their surroundings by Legionella Pneumofila serogroup 6 and Legionella Micdadei. J Prev Med Hyg, 33: 59-64, 1992.
132. Simonsen R.J., Schachtele C.F., Joos R.W.: An evaluation of sterilization by autoclave in dental office. J Dent Res, 58: 400; 1979.
133. Skaug N.: Proper monitoring of sterilization procedures used in oral surgery. Int J Oral Surg, 12 : 153-158; 1983.
134. Smith A.J., Hood J., Bagg J.: Water, water everywhere but not drop to drink? Br Dent J, 186: 12-14, 1999.
135. Storer R., McCabe J.F.: An investigation of methods avaiable for sterilising impressions. Br. Dent. J., 151: 217-219, 1981.
136. Thomas L.E, Sydiskis R.J., DeVore D.T.: Survival of herpes simplex virus and ather seleted microorganisms on petient charts: potential source of infection. JADA, 111: 461-464, 1985.
137. Thraenhart O., Catoni E.: Rischio della trasmissione del virus dell’epatite B e sua profilassi nell’ambito odontoiatrico, con alcune osservazioni riguardo ai disinfettanti attivi sul virus dell’epatite B. Elle/bi-dental materials, Gennaio 1989.
138. Timbrell V., Eccles J.D.: The respirability of the aerosol produced in dentistry. J Dent, 12: 21; 1973.
139. Tonne E., Zschunke E.: Studies on the spatial aerosol spreading during the use of turbines. Stomatol DDR, 27(7):440-5.
140. U.S. Department of Health and Human Services: Proceedings National Conference of Infection Control in Dentistry. Public Health Service, Chicago, Illinois, May 13-14, 1986.
141. U.S. Department of Health and Human Services: Practical Infection Control in the Dental Office. A Workbook for Dental Team. Public Health Service, Dec. 1989.
142. UNI EN 285. Sterilizzazione - Sterilizzatrici a vapore - Grandi sterilizzatrici - Requisiti e prove, 1996.
143. UNI EN 554. Sterilizzazione dispositivi medici: Metodo per la convalida e per il controllo sistematico della sterilizzazione a vapore, 1994.
144. UNI EN 556. Sterilizzazione dei dispositivi medici. Requisiti per i dispositivi medici che recano l’indicazione “sterile”, 1994.
145. Vallania G., Legnani P.P., Casadio Prati G.L., Ortensi L.: Impronte e contaminazione microbica: modello sperimentale di studio. Dental Cadmos,15: 66-71, 1995.
146. Watson C.M., Whitehouse R.L.S. Possibility of cross-contamination between dental patients by means of saliva ejector. JADA, 124: 77-80, 1993.
147. Whitehouse R.L.S., Peters E., Lizotte J.: Influence of biofilms on microbial contamination in dental unit water. J Dent, 19: 290-295, 1991.
148. Williams H.N., Paszko-Kolva C., Shahamat M. : Molecular tecniques reveal high prevalence of Legionella in dental units. JADA, 127: 1188-1193, 1996.
149. Williams J.F., Johnston A.M., Johnson B.: Microbial contamination of dental unit water lines: intensity and microbiological characteristics. J Am Dent Assoc, 124: 59-65, 1993.
150. Williams J.F., Molinari J.A., Andrews N.: Microbical contamination of dental unit waterlines: origins and characteristics. Compendium, 17: 538-558, 1996.